微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某同学做“证明鸡蛋壳的主要成分是碳酸盐”的实验时,设计了如图所示的方案。经检验装置气密性合格并加入试剂。下列说法中不正确的是( )
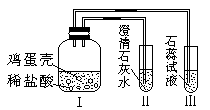
A.鸡蛋壳发生了分解反应
B.Ⅰ中发生的现象为鸡蛋壳逐渐溶解,产生大量气泡
C.II中的澄清石灰水变浑浊
D.III中紫色石蕊试液变红
参考答案:A
本题解析:
试题分析:A项:鸡蛋壳中含有的碳酸盐与稀盐酸发生复分解反应,故错。故选A。
点评:本题考查的是常见无机化合物的性质,难度不大,掌握好基础知识很容易解得本题。
本题难度:一般
2、实验题 某化学兴趣小组查阅资料得知镁可在氮气中燃烧生成Mg3N2,并设计如下实验方案进行探究。?
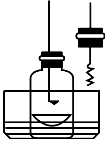
步骤1:用盛水的水槽、无底的废广口瓶、燃烧匙、蒸发皿、胶塞等装配如图所示的装置。另准备一只胶塞,其中有一根铜丝穿过,铜丝末端固定一根镁条备用。
步骤2:引燃燃烧匙中的试剂,塞好瓶塞。燃烧结束后,调节广口瓶内外液面相平。
步骤3:点燃镁条,更换胶塞,镁条继续燃烧,反应结束后,广口瓶内水面上升。
步骤4:取蒸发皿中得到的固体,加盐酸溶解。向溶液中加入过量氢氧化钠溶液,有白色沉淀生成,同时得到一种能使湿润红色石蕊试纸变蓝的气体。
(1)为除去广口瓶中的氧气,燃烧匙中最好应装入下列试剂中的______________(填序号) 。
A.炭粉 B.铁粉 C.红磷
(2)步骤2中调节内外液面相平的方法:_________________________
(3)写出Mg3N2溶于足量盐酸生成两种氯化物的化学方程式:_________________________。
(4)某同学直接将镁条在空气中点燃,并将所得白色固体进行步骤4的实验,结果无气体生成,其原因是_________________________。
(5)兴趣小组同学为比较镁和铝的金属性强弱,设计了下表中的实验方案一,请你再设计一种不同的实验方案。实验试剂和用品:镁条、铝条、0.1mol·L-1MgCl2溶液、0.1 mol·L-1AlCl3溶液、0.1mol·L-1
HCl溶液、0.1mol·L-1 NaOH 溶液、pH 试纸(其他实验仪器可任选)

参考答案:(1)C
(2)向水槽中加水
(3)Mg3N2+
本题解析:
本题难度:困难
3、选择题 只用一种试剂即可区别的:NaCl、MgCl2、FeCl3、Al2(SO4)3四种溶液,这种试剂是( )
A.AgNO3
B.NaOH
C.BaCl2
D.HCl
参考答案:A、加入硝酸银溶液,NaCl、MgCl2、FeCl3、Al2
本题解析:
本题难度:一般
4、选择题 下列实验操作或方法中,正确的是
A.大量氯气泄漏时,迅速离开现场,并尽量往低处去
B.因为固体氯化钠溶解时热效应不大,所以可以在容量瓶中溶解氯化钠固体
C.用加热的方法分离氯化钠和氯化铵固体
D.用溶解、过滤的方法除去粗盐中的氯化钙和氯化镁等杂质
参考答案:C
本题解析:
试题分析:A项:氯气的密度大于空气的密度,应往上去;B项:容量瓶是在常温下配置溶液的容器,不能用来反应或直接在里面溶液溶质;C项氯化钠加热不分解,氯化铵加热分解,可用加热的方法分离氯化钠和氯化铵固体:D项:过滤是除去不溶物的实验操作,而氯化钙和氯化镁都是可溶的杂质。故选C。
点评:基本的化学实验操作的考查。氯气的物理性质:是黄绿色的气体、氯气有毒、并有刺激性气味、密度比空气大、熔沸点较低、能溶于水易溶于有机溶剂、在压强为101kPa、温度为-34.6℃时易液化。如果将温度继续冷却到-101℃时,液氯变成固态氯。1体积水在常温下可溶解2体积氯气.氯气有毒,闻有毒气体气味的方法是(扇动法):用手轻轻在瓶口扇动,使极少量的气体飘进鼻孔。容量瓶是为配制准确的一定物质的量浓度的溶液用的精确仪器(注意:常温下),不能在其里面溶解物质,发生化学反应。
本题难度:简单
5、实验题 (15分)通过测量一定质量的Fe、Al合金与M的溶液反应生成H2在标准状况下的体积,可以计算出合金中Fe、Al的旗量分数,若用下图装置来制取H2,请完成下列操作步骤直至产生H2。
 ?
?
(1)C处塞入玻璃丝绒团;
(2) A处 ___________________________
(3) B处_____________________________
(4) ____________________________________
(5) ____________________________________;
(6) 在分液櫬斗中加入M的溶液。
(7) ______________________________________________________
参考答案:(2)A处插入分液漏斗(3) B处插入带有橡皮管和止水夹的玻
本题解析:本题考查Fe、Al的性质及实验设计。要测定Fe、Al的旗量分数,先要测定出Fe或Al的质量,根据Fe、Al的性质,应让混合物NaOH溶液反应,此时只有Al发生反应放出H2,根据H2体积就可以计算出Al的质量,从而计算出Fe、Al的质量分数。
本题难度:一般