微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 能使水的电离平衡右移,且水溶液显酸性的粒子是()
A.H+
B.OH-
C.Al3+
D.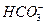
参考答案:C
本题解析:Al3+、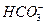 水解促使水的电离,平衡右移,Al3+水解呈酸性,
水解促使水的电离,平衡右移,Al3+水解呈酸性,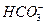 水解呈碱性。
水解呈碱性。
本题难度:简单
2、选择题
A.生成了一种强酸弱碱盐
B.弱酸溶液和强碱溶液反应
C.弱酸溶液和弱碱溶液反应
D.一元强酸溶液和一元强碱溶液反应
参考答案:B
本题解析:酸和碱溶液混合后所得溶液呈酸性,其原因有下列两种可能:(1)两种溶液恰好完全反应,但参与反应的是弱碱和强酸,生成强酸弱碱盐容易水解而显酸性。(2)酸和碱并没有恰好完全反应,反应以后酸有剩余,因而溶液显酸性。本题中的酸溶液H+离子浓度只有1×10-3 mol·L-1。如果此酸是强酸,它是完全电离的,可见它是一种稀溶液;如果是弱酸,因为它只有少部分电离,则弱酸的浓度可能较大。选项B是符合条件的答案,混合后的溶液呈酸性这表明所用的是较浓的弱酸实际上是过量的。如果酸是强酸、碱是弱碱,按前分析,两者不可能是等浓度的
本题难度:简单
3、选择题 常温下,下列有关叙述正确的是???????(???)
A.0.1 mol·L-1醋酸溶液加水稀释后,各离子浓度均减小
B.pH=7的NH4Cl和氨水混合溶液中,c(NH+4)=c(Cl—)
C.加热滴有酚酞的CH3COONa溶液,溶液颜色变浅
D.0.1 mol·L-1 Na2CO3溶液中,c(HCO—3)>c(OH—)
参考答案:B
本题解析:略?常温下水、酸碱的稀溶液Kw值不变,醋酸加水稀释后,pH增大,c(H+)减小,c(OH-)增大,A错;根据电子守恒原理c(NH+4)+c(H+) c(Cl—)+c(OH-),pH=7时,c(H+)c(OH-),所以c(NH+4)=c(Cl—),B正确;加热醋酸根的水解平衡享有移动,c(OH-)增大,溶液颜色变深
c(Cl—)+c(OH-),pH=7时,c(H+)c(OH-),所以c(NH+4)=c(Cl—),B正确;加热醋酸根的水解平衡享有移动,c(OH-)增大,溶液颜色变深
本题难度:一般
4、选择题 下列溶液中微粒浓度关系不正确的是(??)
A.常温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)=c(NH4+)
B.pH=1的一元酸和pH=13的一元碱等体积混合:c(OH-)=c(H+)
C.0.1 mol·L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-)
D.0.1 mol·L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S)
参考答案:AC
本题解析:氨水与氯化铵的混合溶液中存在电荷守恒:c(NH4+)+c(H+)=c(OH-)+c(Cl-),常温下溶液pH=7,即c(H+)=c(OH-),所以c(NH4+)=c(Cl-),A项正确;选项B,没有指明酸、碱的强弱,故不能判断溶液的酸碱性,B项错;(NH4)2SO4中NH4+的水解是微弱的(水解显酸性),故0.1 mol·L-1的(NH4)2SO4溶液中:0.1 mol·L-1<c(NH4+)<0.2 mol·L-1,则有c(NH4+)>c(SO42-)>c(H+)>c(OH-),C项正确;硫化钠溶液中存
本题难度:一般
5、选择题 为了使Na2CO3溶液中C(Na+)/C(CO32-)的比值变小,可适量加入( )
A.KOH溶液
B.盐酸
C.NaOH固体
D.NaOH溶液
参考答案:A、加入氢氧化钾固体,会抑制碳酸根水解,加入水稀释会导致溶液
本题解析:
本题难度:一般