微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (6分)(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-)(填“>”或“=”或“<”)。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,溶液中
c(Na+) c(CH3COO-)(填“>”或“=”或“<”)
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积。(填“>”或“=”或“<”)
参考答案:⑴ 碱性 > ⑵ 酸
本题解析:
试题分析:(1)醋酸为弱电解质,将等体积、等物质的量浓度的醋酸和氢氧化钠溶液混合后,恰好生成CH3COONa,为强碱弱酸盐,溶液呈碱性,c(OH-)>c(H+),溶液中存在:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),则c(Na+)>c(CH3COO-);(2)醋酸为弱电解质,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合,醋酸过量,溶液呈酸性,则c(H+)>c(OH-),溶液中存在:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),则c(Na+)<c(CH3COO-)。(3)将物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中存在:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),已知c(CH3COO-)=c(Na+),则c(OH-)=c(H+),所以溶液呈中性,因醋酸为弱酸,如二者等体积混合,反应后生成CH3COONa,为强碱弱酸盐,溶液呈碱性,为使溶液呈中性,醋酸应稍过量,则醋酸的体积大于氢氧化钠溶液体积。
考点:考查酸碱混合时的定性判断。
本题难度:一般
2、填空题 (18分)(1)一定温度下,向1 L 0.1 mol·L-1 CH3COOH溶液中加入0.1 mol CH3COONa固体,则醋酸的电离平衡向________(填“正”或“逆”)向移动;溶液中 的值________(填“增大”、“减小”或“不变”)。
的值________(填“增大”、“减小”或“不变”)。
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5;
b.CH3COOH+NaHCO3 CH3COONa+CO2↑+H2O。
CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈________性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈________性,NH4HCO3溶液中物质的量浓度最大的离子是________(填化学式)。
(3)99 ℃时,Kw=1.0×10-12,该温度下测得0.1 mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为_____________________________。
②该温度下,将0.01 mol·L-1 H2A溶液稀释到20倍后,溶液的pH=________。
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气_____。
A.盐酸多
B.H2A多
C.一样多
D.无法确定
④将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为_______________________________________。
参考答案:(1)逆 不变
(2)中 碱 NH4+
(3)①
本题解析:
试题分析:(1)一定温度下,向1 L 0.1 mol·L-1 CH3COOH溶液中加入0.1 mol CH3COONa固体,因为醋酸溶液中存在CH3COOH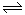 H++CH3COO-,则醋酸根离子浓度增大,平衡逆向移动;
H++CH3COO-,则醋酸根离子浓度增大,平衡逆向移动; 即为醋酸的电离常数,因为温度不变,所以电离常数不变;
即为醋酸的电离常数,因为温度不变,所以电离常数不变;
(2)醋酸与NH3·H2O的电离平衡常数相同,则铵根离子与醋酸根离子的水解程度相同,所以溶液呈中性;醋酸的酸性比碳酸强,所以碳酸氢根离子的水解程度大于醋酸根离子的水解程度也大于铵根离子的水解程度,碳酸氢根离子的水解使溶液呈碱性,所以碳酸氢铵溶液呈碱性;则NH4HCO3溶液中物质的量浓度最大的离子是NH4+;
(3)①99 ℃时,Kw=1.0×10-12,c(H+)=c(OH-)=10-6mol/L,因此pH=6的溶液为中性。则该温度下测得0.1 mol·L-1 Na2A溶液的pH=6,所以H2A为二元强酸,完全电离,电离方程式为H2A 2H++A2-;
2H++A2-;
②该温度下,0.01 mol·L-1 H2A溶液中氢离子的物质的量浓度是0.02mol/L,稀释到20倍后,氢离子浓度变为0.02mol/L/20=0.001mol/L,溶液的pH=-lg0.001=3;
③体积相等、pH=1的盐酸与H2A溶液中氢离子的物质的量相等,则与足量的Zn反应时产生的氢气一样多,答案选C;
④将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,二者恰好完全反应生成(NH4)2A和水,铵根离子水解使溶液呈酸性,所以溶液中离子浓度的大小关系是c(NH4+)>c(A2-)>c(H+)>c(OH-)。
考点:考查电解质的电离平衡移动的判断,电离常数的判断,离子浓度的比较,电解质强弱的判断,盐的水解程度的比较,溶液酸碱性的判断
本题难度:困难
3、选择题 下列溶液中各微粒的浓度关系不正确的是
A.0.1 mol/L的HCOOH溶液中:c(HCOO—)+c(OH—)=c(H+)
B.1 L 0.1 mol/L的CuSO4·(NH4)2SO4·6H2O的溶液中: c(SO42—)>c(NH4+)>c(Cu2+)>c(H+)>c (OH—)
C.0.1 mol/L 的NaHCO3溶液中: c(Na+)+c(H+)=c(HCO3—)+2c(CO32—)+c(OH—)
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:
c(Na+)>c(HX)>c(X—)>c(H+)>c(OH—)
参考答案:D
本题解析:
试题分析:A、根据电荷守恒可知,0.1 mol/L的HCOOH溶液中:c(HCOO—)+c(OH—)=c(H+),A正确;B、铜离子和铵根离子均水解,溶液显酸性,所以1 L 0.1 mol/L的CuSO4·(NH4)2SO4·6H2O的溶液中: c(SO42—)>c(NH4+)>c(Cu2+)>c(H+)>c (OH—),B正确;C、根据电荷守恒可知0.1 mol/L 的NaHCO3溶液中: c(Na+)+c(H+)=c(HCO3—)+2c(CO32—)+c(OH—),C正确;D、根据电荷守恒可知,在等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中存在c(Na+)+ c(H+)=c(X—)+c(OH—),所以不可能存在c(Na+)>c(HX)>c(X—)>c(H+)>c(OH—),D错误,答案选D。
考点:考查溶液中离子浓度大小比较
本题难度:困难
4、选择题 下列各溶液中,相关微粒物质的量浓度关系不正确的是
A.0.1 mol·L-1NaHCO3溶液中:c(OH-)=c(H+)+c(H2CO3)-c(CO32-)
B.0.1 mol·L-1NH4Cl溶液中:c(Cl-)=c(NH4+)+c(NH3·H2O)=0.1 mol·L-1
C.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A-)
D.常温下,浓度为0.1 mol·L-1 NaHSO3溶液的pH<7:c(Na+)>c(HSO3-)>c(SO32-)> c(H+)
参考答案:D
本题解析:
试题分析:A、碳酸氢钠溶液中存在电荷守恒和物料守恒,根据电荷守恒得c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),根据物料守恒得c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),所以得c(OH-)=c(H+)+c(H2CO3)-c(CO32-),故A正确;B、任何电解质溶液中都存在物料守恒,根据物料守恒得c(Cl-)=c(NH4+)+c(NH3?H2O)=0.1mol?L-1,故B正确;C、任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)+c(M+)=c(OH-)+c(A-),故C正确;D、常温下,浓度为0.1mol?L-1 NaHSO3溶液的pH<7,说明HSO3-电离程度大于水解程度,HSO3-和水都电离出氢离子,只有HSO3-电离出SO32-,所以c(SO32-)<c(H+),故D错误。
考点:本题考查离子浓度比较。
本题难度:困难
5、选择题 下列离子方程式中,属于水解反应的是
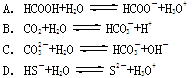
参考答案:C
本题解析:
试题分析:A.为醋酸的电离方程式,故不选A;B.为碳酸的电离方程式。故不选B;C.为碳酸根离子的水解,故选C;D.为硫氢根离子的电离方程式,故不选D。
考点:水解反应的离子方程式和电离方程式的判断。
本题难度:一般