微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法不正确的是
A.锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后,再将不溶物用稀盐酸溶解去除
B.常温下pH都等于5的CH3COOH溶液和NH4Cl溶液中,水的电离程度前者比后者大
C.BaSO4(s)+4C(s)===BaS(s)+4CO(g)室温下不能自发进行,说明该反应的ΔH
参考答案:
本题解析:
本题难度:一般
2、选择题 已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如下表,下列叙述正确盼是( )
| 酸 | 电离平衡常数
醋酸
Ki=1.75×10-5
次氯酸
Ki=2.98×10-8
碳酸
Ki1=4.30×10-7
Ki2=5.61×10-11
亚硫酸
Ki1=1.54×10-2
Ki2=1.02×10-7
A.将0.1?mol/L的醋酸加水不断稀释,c(CH3COO-)始终减小
B.少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-=CO32-+2HClO
C.少量的SO2通入Ca(ClO)2溶液中反应的离予方程式为:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
D.25℃,等浓度的CH3COONa、NaClO、Na2CO3和Na2SO3溶液中,碱性最强的是NaClO
参考答案:A
本题解析:
本题难度:简单
3、选择题 在下列叙述中,能说明盐酸是强酸,醋酸是弱酸的是
A.将pH=4的盐酸和醋酸稀释成pH=5的溶液,盐酸加水后体积为原溶液的10倍,醋酸所需加入的水量比前者多
B.盐酸和醋酸都可用相应的钠盐与浓硫酸反应制取
C.相同pH的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸的pH变大
D.pH值相同的盐酸和醋酸分别跟锌反应时,产生氢气的起始速率相等
参考答案:AC
本题解析:
试题分析:盐酸加水后体积为原溶液的10倍,由pH=4变为pH=5,说明盐酸为强酸、醋酸加水后体积为原溶液的10倍,由pH=4变为4<pH<5,说明醋酸味弱酸,故A正确;盐酸中加入氯化钠,PH不变,说明盐酸为强酸、醋酸中加入醋酸钠,抑制醋酸的电离,PH变大,说明醋酸味弱酸,故C正确。
考点:本题考查化弱电解质电离。
本题难度:一般
4、填空题 (12分)(1)常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入 0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
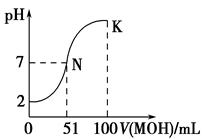
①由图中信息可知HA为________(填“强”或“弱”),理由是___________。
②常温下一定浓度的MA稀溶液的pH=a,则a________7(填“>”、“<”或“=”)。
③请写出K点所对应的溶液中离子浓度的大小关系: 。
(2)已知25 ℃时0.1 mol·L-1醋酸溶液的pH约为3,向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
①为了验证上述哪种解释正确,做如下实验:向0.1 mol·L-1的醋酸溶液中加入少量下列物质中的________(填写编号),然后测定溶液的pH。
A.固体CH3COOK
B.固体CH3COONH4
C.气体NH3
D.固体NaHCO3
②若乙的解释正确,溶液的pH应________(填“增大”“减小”或“不变”)。
参考答案:(1)①强 0.01 mol·L-1HA的pH为
本题解析:
试题分析:(1)①因为浓度0.01mol/L,pH=2,故该酸为一元强酸;②V=50ml滴定终点时,pH<7,为强酸弱碱盐,水解为酸性。故该碱为弱碱,M++H2O MOH+H+,a<7;③K点为MA和MOH的混合溶液,故离子浓度大小关系为c(M+)>c(A-)>c(OH-)>c(H+)。(2)①CH3COONH4溶液中,CH3COO-和NH4+都发生水解,且水解程度相等,CH3COONH4溶液呈中性,将CH3COONH4加入到0.1 mol?L-1醋酸中,如pH增大,说明CH3COO-抑制了醋酸的电离,其它物质的水溶液都呈碱性,不能用于证明; MOH+H+,a<7;③K点为MA和MOH的混合溶液,故离子浓度大小关系为c(M+)>c(A-)>c(OH-)>c(H+)。(2)①CH3COONH4溶液中,CH3COO-和NH4+都发生水解,且水解程度相等,CH3COONH4溶液呈中性,将CH3COONH4加入到0.1 mol?L-1醋酸中,如pH增大,说明CH3COO-抑制了醋酸的电离,其它物质的水溶液都呈碱性,不能用于证明;
②CH3COONH4溶液呈中性,加入CH3COONH4,如pH不变,说明是由于水解的原因,如pH变大,是由于醋酸根离子抑制了醋酸的电离,使c(H+)减小,溶液的pH应增大。
考点:考查弱电解质的电离平衡、盐类水解。
本题难度:一般
5、选择题 已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH值:
溶质
| CH3COONa
| NaHCO3
| Na2CO3
| NaClO
| NaCN
| C6H5ONa
| pH
| 8.8
| 9.7
| 11.6
| 10.3
| 11.1
| 11.3
?
下列说法或表达中,正确的是
A.少量二氧化碳通入NaClO溶液中:2NaClO + CO2 + H2O Na2CO3 + 2HClO Na2CO3 + 2HClO
B.过量的HCN滴入碳酸钠溶液中HCN + Na2CO3 NaCN+ NaHCO3 NaCN+ NaHCO3
C.结合质子能力由强到弱的顺序为:CO32—>CN—>HCO3—>CH3COO—
D.常温下电离常数:Ki2(H2CO3)>Ki(C6H5OH)>Ki(HCN)
参考答案:BC
本题解析:
试题分析:A、碳酸钠溶液的pH大于次氯酸钠溶液的pH,说明前者水解程度大,因此酸性是次氯酸强于碳酸氢钠,则少量二氧化碳通入NaClO溶液中:NaClO + CO2 + H2O NaHCO3 + HClO,A不正确;B、NaCN溶液的pH介于碳酸氢钠和碳酸钠之间,所以酸性是碳酸>HCN>HCO3—,所以过量 NaHCO3 + HClO,A不正确;B、NaCN溶液的pH介于碳酸氢钠和碳酸钠之间,所以酸性是碳酸>HCN>HCO3—,所以过量
本题难度:一般
|
|