微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 已知2SO2(g)+ O2(g) 2SO3(g) △H<0 ,温度一定,体积为3L的密闭容器中,投入2 mol SO2和1 molO2, 2min反应达平衡时,容器中有1.2 mol SO3,放出热量117.6 kJ,试计算:
2SO3(g) △H<0 ,温度一定,体积为3L的密闭容器中,投入2 mol SO2和1 molO2, 2min反应达平衡时,容器中有1.2 mol SO3,放出热量117.6 kJ,试计算:
(1)写出该反应的热化学方程式。??
(2)该反应中SO2的转化率是多少?
(3)其他条件相同,若起始时改为充入2 mol SO3,,计算达平衡后SO3的质量分数为多少?
参考答案:(6分,每空2分)
(1)2SO2(g)+ O2(g)
本题解析:考查热化学方程式的书写,可逆反应的有关计算,一般采用三段式。
2SO2(g)+ O2(g) 2SO3(g)
2SO3(g)
起始量(mol)??? 2?????? 1???????? 0
转化量(mol)??? 2x????? x???????? 2x+
平衡量(mol)? 2-2x??? 1-x?????? 2x
所以有2x=1.2mol
解得x=0.6mol
(1)因此如果消耗1mol氧气放出的热量是117.6 kJ÷0.6=196 kJ/mol
所以反应的热化学方程式是2SO2(g)+ O2(g) 2SO3(g)???△H=-196 kJ/mol
2SO3(g)???△H=-196 kJ/mol
(2)反应中SO2的转化率是2x÷2=0.6,即60%
(3)若起始时改为充入2 mol SO3,则平衡是等效的,因此平衡后SO3的质量分数为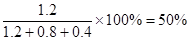
本题难度:一般
2、选择题 如图表示外界条件(温度、压力)的变化对下列反应的影响:L(s)+G(g) 2R(g)?ΔH>0。在图中Y轴是指
2R(g)?ΔH>0。在图中Y轴是指

A.平衡混合气中R的质量分数
B.G的转化率
C.平衡混合气中G的体积分数
D.L的转化率
参考答案:C
本题解析:
试题分析:A、升温,平衡正向移动,R的质量分数增大,与图像不符,故A错误;B、升温,平衡正向移动,G的转化率增大,与图像不符,故B错误;C、升温,平衡正向移动,平衡混合气中G的体积分数减小;增大压强,平衡逆向移动,G的体积分数增大,与图像一致,故C正确;D、温度升高,平衡正向移动,L的转化率增大,与图像不符,故D错误。
本题难度:一般
3、选择题 反应:A + 3B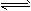 2C + D,在四种不同情况下的反应速率分别为:
2C + D,在四种不同情况下的反应速率分别为:
① ②
②
③ ④
④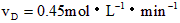
该反应进行得最快的是 [???? ]
A.①
B.④
C.①④
D.②③
参考答案:B
本题解析:
本题难度:简单
4、选择题 反应4A(s)+3B(g)? = 2C(g)+D(s),经2min,B的浓度减少0.6 mol/L。对此反应速率的表示不正确的是?
[???? ]
A.在2 min内的反应速率用B表示为0.3 mol/(L·min)
B.在2 min内用C表示反应速率是0.2 mol/(L·min)
C.v (B)=3v (D)
D.v (A)=0.4 mol/(L·min)
参考答案:D
本题解析:
本题难度:一般
5、填空题 工业废水中常含有一定量的Cr2O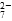 和CrO
和CrO ,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为
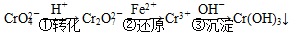
其中第①步存在平衡:
2CrO (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O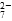 (橙色)+H2O
(橙色)+H2O
(1)若平衡体系的 pH = 2,该溶液显________色。
(2)能说明第①步反应达平衡状态的是________。
a.Cr2O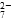 和CrO
和CrO ?的浓度相同
?的浓度相同
b.2v(Cr2O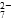 )=v(CrO
)=v(CrO )
)
c.溶液的颜色不变
(3)第②步中,还原 1 mol Cr2O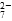 ?离子,需要______mol的FeSO4·7H2O。
?离子,需要______mol的FeSO4·7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)  Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使 c(Cr3+)降至10-5mol/L,溶液的pH应调至________。
方法2:电解法
该法用 Fe 做电极电解含Cr2O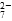 的酸性废水,随着电解的进行,在阴极附近溶液 pH 升高,产生 Cr(OH)3沉淀。
的酸性废水,随着电解的进行,在阴极附近溶液 pH 升高,产生 Cr(OH)3沉淀。
(5)用Fe做电极的原因为______________________________________
(6)在阴极附近溶液 pH 升高的原因是(用电极反应解释)________________,溶液中同时生成的沉淀还有________。
参考答案:(1)橙 (2)c (3)6 (4)5
(5)阳极反应
本题解析:本题主要结合工业废水的处理考查溶液中的平衡问题、氧化还原反应和电解原理的应用等知识,意在考查考生综合运用化学理论知识解决实际问题的能力。
(1)pH = 2 时,反应正向进行的速率较大,溶液呈橙色。
(2)达到平衡状态时,正逆反应速率相等,混合物中各组分浓度保持不变,但不一定相等,溶液的颜色不再发生改变,即只有 c 正确。
(3)根据反应前后 Cr 和 Fe 元素的化合价变化,可确定还原 1 mol Cr2O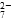 需 6 mol FeSO4·7H2O。
需 6 mol FeSO4·7H2O。
(4)当 c(Cr3+)= 10-5 mol/L时,根据 Ksp的表达式可求出 c(OH-)= 10-9 mol/L,则此时溶液 pH = 5。
(5)用铁做阳极,反应中生成Fe2+,提供还原剂。
(6)阴极 H+得电子生成 H2,随着电解的进行,溶液的 pH逐渐增大,溶液中还会生成 Fe(OH)3沉淀。
本题难度:一般