微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各溶液中,微粒的物质的量浓度关系正确的是
A.pH=5的NaHSO3溶液中:c(HSO3—)>c(H2SO3)>c(SO32—)
B.使酚酞呈红色的苯酚与苯酚钠混合溶液中:c(Na+)>c(C6H5O-)>c(OH―)>c(H+)
C.在0.1 mol·L-1 Na2CO3溶液中:c(HCO3-)=c(H2CO3)+c(H+)-c(OH-)
D.等物质的量浓度、等体积的NaOH溶液与CH3COOH溶液混合所得溶液中:
c(Na+)=c(CH3COO-)+c(CH3COOH)
参考答案:BD
本题解析:NaHSO3溶液显酸性,说明电离程度大于水解程度,所以A不正确。使酚酞呈红色,说明溶液显碱性,因此苯酚钠的水解程度大于苯酚的电离程度,B正确。C不正确,不符合质子守恒。D正确,符合物料守恒,答案选BD。
本题难度:一般
2、选择题 下列各组离子中,因相互促进水解,而不能大量共存的是(??? )
A.OH-、Na+、K+、HCO3-
B.Na+、HCO3-、Fe3+、Cl-
C.H+、HS-、Na+、SO32-
D.Al3+、SO42-、CO32-、Cl-
参考答案:BD
本题解析:相互促进水解,则必须同时含有弱酸的阴离子和弱碱的阳离子,且两者进行的比较彻底。
本题难度:一般
3、选择题 某温度下,0.1 mol·L-1 NaHCO3溶液pH=10,下列判断正确的是( )。
A.c(OH-)=10-4 mol·L-1
B.加入少量NaOH固体,c(Na+)和c(HCO3—)均增大
C.c(Na+)+c(H+)=c(HCO3—)+c(OH-)
D.c(Na+)=c(HCO3—)+c(CO32—)+c(H2CO3)
参考答案:D
本题解析:由于没有明确温度,水的电离常数KW可能不是10-14,故c(OH-)不一定为10-4 mol·L-1,故A错误;加入NaOH固体,促进HCO3—电离,c(HCO3—)减小,故B错误;溶液中c(Na+)+c(H+)=c(HCO3—)+c(OH-)+2c(CO32—),故C错误;D项满足物料守恒,故D正确。
本题难度:一般
4、选择题 下列关于各溶液的描述中正确的是?????????? ( )。
A.pH相等的①NH4Cl,②(NH4)2SO4,③NH4HSO4的溶液中,c(NH4+)大小:①=②=③
B.常温下,在10 mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≤20 mL
C.向1.00 L 0.3 mol·L-1的NaOH溶液中缓慢通入CO2气体至溶液增重8.8 g,所得溶液中:3c(Na+)=2[c(HCO3—)+c(CO32—)+c(H2CO3)]
D.浓度均为0.1 mol·L-1的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)-c(CH3COOH)=c(H+)-c(OH-)
参考答案:B
本题解析:NH4Cl,(NH4)2SO4溶液中NH4+水解使溶液呈酸性:NH4++H2O NH3·H2O+H+,但水解是微弱的,NH4HSO4=NH4++H++SO42—,H+全部电离,溶液呈酸性,故c(NH)相同的NH4Cl,(NH4)2SO4,NH4HSO4三溶液中,c(H+)大小:①=②<③,现三溶液pH相同,
NH3·H2O+H+,但水解是微弱的,NH4HSO4=NH4++H++SO42—,H+全部电离,溶液呈酸性,故c(NH)相同的NH4Cl,(NH4)2SO4,NH4HSO4三溶液中,c(H+)大小:①=②<③,现三溶液pH相同,
本题难度:一般
5、选择题 向少量Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,结果固体完全溶解。对此甲、乙两位同学各自作了自己的解释如下:
甲:Mg(OH)2(s) Mg2++2OH-????????????①
Mg2++2OH-????????????①
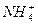 +H2O
+H2O NH3·H2O+H+??????????????②
NH3·H2O+H+??????????????②
H++OH-====H2O??????????????????????????③
由于③的发生使平衡①右移,沉淀溶解。
乙:Mg(OH)2(s) Mg2++2OH-???????????①
Mg2++2OH-???????????①
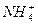 +OH-====NH3·H2O??????????????????②
+OH-====NH3·H2O??????????????????②
由于②的发生使平衡①右移,沉淀溶解。
丙同学用下面的一种试剂,重做了该实验,证明甲、乙的解释只有一种是正确的,他用的试剂是(??? )
A.NH4NO3
B.CH3COONH4
C.(NH4)2SO4
D.氨水
参考答案:B
本题解析:本题为分析评价题,综合考查了溶解平衡、水解平衡及化学反应等知识。要在理解题意的基础上对选项中的四种物质的溶液的酸碱性与氯化铵溶液的酸碱性进行比较,因CH3COONH4溶液呈中性,应选B。
本题难度:简单