微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题  如图所示实验装置进行实验(必要时可以进行加热),下列实验现象描述不正确的是
如图所示实验装置进行实验(必要时可以进行加热),下列实验现象描述不正确的是
A.A
B.B
C.C
D.D
参考答案:C
本题解析:分析:A.H2O2在MnO2催化作用下生成O2,可氧化FeCl2;
B.CaO可与水反应生成氢氧化钙,反应放热促进氨气挥发,氨气和与硝酸银反应;
C.二氧化硫与氯化钡不反应;
D.浓硝酸与铜反应生成二氧化氮气体,二氧化氮与水反应生成硝酸.
解答:A.H2O2在MnO2催化作用下生成O2,可氧化FeCl2生成FeCl3,溶液由浅绿色变为棕黄色,故A正确;
B.CaO具有吸水性,可与水反应生成氢氧化钙,反应放热促进氨气挥发,氨气和与硝酸银反应先生成氢氧化银沉淀,氨气过量继续反应生成银氨溶液,故B正确;
C.二氧化硫与氯化钡不反应,故C错误;
D.浓硝酸与铜反应生成二氧化氮气体,二氧化氮与水反应生成硝酸,硝酸与碳酸氢钠反应生成二氧化碳气体,故D正确.
故选C.
点评:本题考查化学实验方案的评价,涉及物质的制备和检验,侧重于考查学生的综合运用化学知识的能力和评价能力,题目难度不大,注意把握物质性质的异同以及相关实验操作方法.
本题难度:一般
2、选择题 下列有关工业生产的叙述正确的是
A.工业上将氨转变为硝酸及其他氮的化合物是氮的固定
B.三聚氰胺(C3H6N6)是一种食品添加剂,可加在配方奶粉中,但必须控制其含量
C.电解精炼铜时,粗铜中的金、银、锌等形成阳极泥而与铜分离网
D.用明矾净水是因为Al3+水解生成的Al(OH)3胶粒具有很强的吸附性
参考答案:D
本题解析:分析:A.将空气中游离态的氮转化为含氮化合物的过程叫氮的固定;
B.三聚氰胺无营养价值;
C.锌比铜活泼;
D.氢氧化铁胶体可吸附悬浮于水中的杂质.
解答:A.氨和硝酸及其他氮的化合物都是化合物,不是氮的固定,故A错误;
B.三聚氰胺(C3H6N6)不是一种食品添加剂,故B错误;
C.锌比铜活泼,先失电子形成离子,故C错误;
D.明矾可用于净水,是因为明矾溶于水生成胶状物可吸附悬浮于水中的杂质,故D正确.
故选D.
点评:本题考查氮的固定、食品添加剂、明矾净水等,题目难度不大,注意知识的积累.
本题难度:困难
3、选择题 下列实验中,仪器选择正确、能达到实验目的是
A.测定食醋的浓度
B.减压过滤Al(OH)3胶状沉淀
C.分离碘酒中的碘和酒精
D.合成乙酸乙酯
参考答案:D
本题解析:分析:A.NaOH应放在碱式滴定管中;
B.胶体粒子能透过滤纸;
C.碘易溶于水酒精;
D.实验装置符合制备方法.
解答:A.NaOH溶液腐蚀玻璃,应放在碱式滴定管中,故A错误;
B.胶体粒子能透过滤纸,应用渗析的方法分离,故B错误;
C.碘易溶于水酒精,不能用分液的方法分离,故C错误;
D.乙醇和乙酸在浓硫酸作用下加热可制备乙酸乙酯,用饱和碳酸钠溶液吸收,实验装置符合,故D正确.
故选D.
点评:本题考查较为综合,题目侧重于酸碱中和滴定、物质的分离和制备等实验基本操作的考查,题目难度不大.
本题难度:困难
4、选择题 下列实验能达到预期目的是
A.A
B.B
C.C
D.D
参考答案:B
本题解析:分析:A.发生氧化还原反应生成硫酸和HBr;
B.氯气氧化碘离子生成碘单质;
C.Cu为负极,Fe为正极,电池反应为Cu与浓硝酸反应;
D.氯化铵易分解,碘易升华.
解答:A.发生氧化还原反应生成硫酸和HBr,验证SO2的还原性,故A错误;
B.氯气氧化碘离子生成碘单质,氧化剂的氧化性大于氧化产物的氧化性,则可验证Cl的非金属性比I强,故B正确;
C.Cu为负极,Fe为正极,电池反应为Cu与浓硝酸反应,不能说明Fe比Cu活泼,故C错误;
D.氯化铵易分解,碘易升华,则不能利用加热氯化铵和碘单质的固体混合物中分离除去碘,应利用萃取,故D错误;
故选B.
点评:本题考查化学实验方案的评价,涉及氧化还原反应、原电池、物质的分离、提纯等,侧重反应原理的考查,题目难度不大,选项C为易错点.
本题难度:困难
5、选择题 某同学设计如下实验,测量m克铜银合金样品中铜的质量分数:
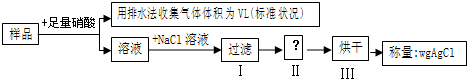
下列说法中错误的是
A.收集到的V?L气体为?NO
B.若缺少操作Ⅱ,会导致实验结果偏小
C.被铜银合金还原的硝酸可能为?
D.依据m、V不能确定铜的质量分数
参考答案:D
本题解析:分析:A、由流程图可知,实验用排水法收集气体,二氧化氮能与水反应生成NO,故金属与硝酸反应生成气体不能是NO或NO2或NO、NO2,最后收集的气体为NO;
B、由流程图可知,溶液中加入氯化钠,将银离子转化为氯化银沉淀,通过测定氯化银沉淀的质量,计算银的质量,进而计算铜的含量,操作Ⅱ是在过滤之后,烘干之前,由于过滤后的氯化银附着一些离子,应洗涤附着的物质,防止测定的氯化银的质量增大;
C、被还原的硝酸全部生成为NO,计算NO的物质的量,再根据N原子转移守恒计算被还原的硝酸;
D、由流程图可知,实验原理为,在反应后溶液中加入氯化钠,将银离子转化为氯化银沉淀,通过测定氯化银沉淀的质量,计算银的质量,进而计算铜的含量.
解答:A、由流程图可知,实验排水法收集,二氧化氮能与水反应生成NO,故金属与硝酸反应生成气体不能是NO或NO2或NO、NO2,最后收集的气体为NO,故A正确;
B、由流程图可知,溶液中加入氯化钠,将银离子转化为氯化银沉淀,通过测定氯化银沉淀的质量,计算银的质量,进而计算铜的含量,操作Ⅱ是在过滤之后,烘干之前,由于过滤后的氯化银附着一些离子,应洗涤附着的物质,防止测定的氯化银的质量增大,导致合金中银的质量增大,铜的质量偏小,测量铜的含量偏低,故B正确;
C、生成的气体是NO,物质的量为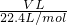 =
=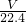 mol,根据原子转移守恒可知被还原的硝酸为
mol,根据原子转移守恒可知被还原的硝酸为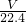 mol,故C正确;
mol,故C正确;
D、氯化银的质量为wg,利用Ag守恒计算合金中银的质量,合金质量减去Ag的质量为Cu的质量,可以确定Cu的质量分数,故D错误;
故选D.
点评:本题考查学生对实验原理的理解、物质组成的测定等,难度中等,理解原理是关键,需要学生具有扎实的基础知识与综合运用知识分析解决问题的能力.
本题难度:困难