微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 列除去杂质的方法正确的是( )
①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离;
②除去蛋白质中少量的蔗糖:用浓(NH4)2SO4溶液溶液,进行盐析、过滤、洗涤;
③除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏.
A.①②
B.②④
C.③④
D.②③
参考答案:①光照条件下通入Cl2,氯气会和乙烷之间发生取代反应,和乙烯
本题解析:
本题难度:简单
2、选择题 下列各组混合物中,用分液漏斗不能分离的是
A.正己烷和水
B.甲苯和水
C.乙酸和乙醇
D.溴苯和水
参考答案:C
本题解析:只有互不相溶的液体之间,才能用分液漏斗进行分离,乙酸和乙醇是互溶的,不能分液,其余都是难溶的,答案选C。
本题难度:一般
3、填空题 CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
沉淀物
| Fe(OH)3
| Fe(OH)2
| Co(OH)2
| Al(OH)3
| Mn(OH)2
|
开始沉淀
| 2.7
| 7.6
| 7.6
| 4.0
| 7.7
|
完全沉淀
| 3.7
| 9.6
| 9.2
| 5.2
| 9.8
?
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式________________________。
(2)写出NaClO3发生反应的主要离子方程式_____________________________;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式_______________。
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为???????????????????。
(4)“操作1”中包含3个基本实验操作,它们依次是_________、__________和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是_________;其使用的最佳pH范围是________________。
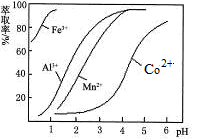
A.2.0~2.5?????B.3.0~3.5?????????C.4.0~4.5?????D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是_____________________。(答一条即可)
参考答案:(1)Co2O3+SO32-+4H+=2Co2++SO42-
本题解析:
试题分析:(1)向水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]
加入盐酸和亚硫酸钠,浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等,所以Co2O3和亚硫酸钠在酸性条件下发生氧化还原,根据电荷守恒和得失电子守恒,反应为:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O;
(2)加入NaClO3,会发生FeCl2中铁元素的化合价+2→+3,失去电子,NaClO3中氯元素的化合价由+5→-1价,得到电子,根据电荷守恒和得失电子守恒,反应为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O,“浸出液”中加过量NaClO3时,有毒气体是氯气,所以推断是NaClO3和“浸出液”中的氯离子发生了氧化还原反应,ClO3-中Cl元素的化合价由+5价降低为0价,HCl中Cl元素的化合价由-1价升高到0,根据电子守恒及质量守恒定律来配平,所以其方程式为:KClO3+6HCl=KCl+3Cl2↑+3H2O,离子方程式是ClO3-+5Cl-+6H+=3Cl2↑+3H2O;
(3)加Na2CO3调pH至5.2,铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳,水解的离子方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;铁离子能与碳酸根离子发生双水解生成氢氧化铁和二氧化碳,水解的离子方程式为:2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑;故答案为:Fe(OH)3、Al(OH)3;
(4)从溶液中制取固体的方法制取氯化钴固体,其操作步骤是蒸发浓缩、冷却结晶和过滤,根据题意知,CoCl2·6H2O常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴,为防止其分解,制得的CoCl2·6H2O需减压烘干;
(5)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子,由萃取剂对金属离子的萃取率与pH的关系可知
调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀,故答案为:除去溶液中的Mn2+;选B;??????????????????????
(6)根据CoCl2·6H2O的组成分析,造成产品中CoCl2·6H2O的质量分数大于100%的原因可能是:含有杂质,导致氯离子含量大,结晶水化物失去部分水,导致相同质量的固体中氯离子含量变大。2·6H2O的工艺流程。
本题难度:困难
4、实验题 芳香族羧酸通常用芳香烃的氧化来制备。芳香烃的苯环比较稳定,难于氧化,而环上的支链不论长短,在强烈氧化时,最终都氧化成羧基。某同学用甲苯的氧化反应制备苯甲酸。反应原理:
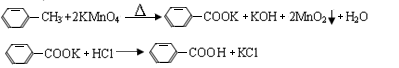
反应试剂、产物的物理常数:
名称
| 相对分子质量
| 性状
| 熔点
| 沸点
| 密度
| 溶解度
| 水
| 乙醇
| 乙醚
| 甲苯
| 92
| 无色液体易燃易挥发
| -95
| 110.6
| 0.8669
| 不溶
| ∞
| ∞
| 苯甲酸
| 122
| 白色片状或针状晶体
| 122.4
| 248
| 1.2659
| 微溶
| 易溶
| 易溶
主要实验装置和流程如下:

图1回流搅拌装置??????????????????????????图2抽滤装置??
实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在100℃时,反应一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
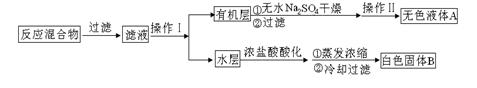
(1)仪器K的名称为?????。无色液体A的结构简式为?????。操作Ⅱ为?????。
如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是?????。
(3)下列关于仪器的组装或者使用正确的是?????。
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌棒下端不能与三颈烧瓶底、温度计等接触
C.抽滤结束后,为防止倒吸,应先关闭水龙头,再断开真空系统与过滤系统的连接
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入?????,分液,水层再加入?????,然后抽滤,干燥即可得到苯甲酸。
(5)纯度测定:称取1.220g产品,配成100ml溶液,取其中25.00ml溶液,进行滴定,消耗KOH物质的量为2.4×10-3mol。产品中苯甲酸质量分数为?????。
参考答案:(1)安全瓶(1分) 本题解析: 本题解析:
试题分析:
(1)仪器K为减压过滤(抽滤)装置中的安全瓶;
由实验流程可知,反应混合物首先经过过滤除去用高锰酸钾氧化甲苯后生成的MnO2
沉淀,过滤后的滤液经分液得到含有末反应的甲苯的有机层和含有苯甲酸钾等可溶性物质的水层。然后,将有机层经干燥剂干燥、过滤,再经蒸馏回收得到甲苯,所以无色液体A
为甲苯( )。根据反应原理,可知水层中的 )。根据反应原理,可知水层中的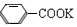 经浓盐酸酸化,转化为苯甲酸,因苯甲酸微溶于水,再经蒸发浓缩,冷却结晶,就可得到白色的苯甲酸晶体(无色固体B)。 经浓盐酸酸化,转化为苯甲酸,因苯甲酸微溶于水,再经蒸发浓缩,冷却结晶,就可得到白色的苯甲酸晶体(无色固体B)。
(2) 滤液呈紫色,说明滤液中含有末反应的高锰酸钾,亚硫酸氢钾是一种还原剂,先加亚
硫酸氢钾,是使其与高锰酸钾反应,除去末反应的高锰酸钾,否则当用浓盐酸酸化时,高
锰酸钾就会与浓盐酸反应产生氯气。
(3) 抽滤可以加快过滤速度,得到较干燥的沉淀;安装电动搅拌器时,搅拌棒下端不能与三颈烧瓶底、温度计等接触;抽滤结束后,为防止倒吸,应先断开真空系统与过滤系统的连接,再关闭水龙头;冷凝管中水的流向应是下进上出。C不正确,A、B、D正确。
(4) 甲苯不溶于水,要除去残留在苯甲酸中的甲苯时,先加入NaOH溶液,使其与苯甲酸反应,将苯甲酸转化为可溶性的苯甲酸钠,再经分液操作,将甲苯(有机层)除去,然后再用浓盐酸酸化,把可溶性的苯甲酸钠转化为苯甲酸。
(5) 根据反应: 
122g?????? 1mol
m?????? 2.4×10-3mol
m="122g/mol" ×2.4×10-3mol = 1.1712g;
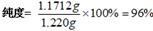
本题难度:一般
5、选择题 下列分离、提纯物质的方法正确的是
A.用过滤的方法除去NaCl溶液中含有的少量淀粉胶体
B.分离汽油和水的混合物最好用蒸馏的方法
C.用分液的方法分离四氯化碳和水的混合物
D.用溶解、过滤的方法提纯含有少量BaCl2的NaCl
参考答案:C
本题解析:略
本题难度:一般
|
|