c(HCO3-)
c(CO32-)
减小
D.加入?NaOH固体,溶液?pH减小
参考答案:A、平衡常数仅与温度有关,温度不变,则稀释时平衡常数是不变的
本题解析:
本题难度:简单
2、选择题 25 ℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是( )
A.均存在电离平衡和水解平衡
B.存在的粒子种类相同
C.c(OH-)前者大于后者
D.分别加入NaOH固体,恢复到原温度,c(C )均增大 )均增大
参考答案:C
本题解析:本题主要考查盐类的水解和弱电解质的电离。NaHCO3和Na2CO3溶液中都存在盐的水解平衡和水的电离平衡,A正确;HC 水解和电离后与C 水解和电离后与C 本题难度:一般 本题难度:一般
3、填空题 (1)工业上用氨和二氧化碳反应合成尿素。已知下列物质在一定条件下均能与水反应产生 。H2是合成氨的原料, 。H2是合成氨的原料,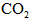 供合成尿素用。若从充分利用原料的角度考虑,选用________(填序号)物质作原料较好. 供合成尿素用。若从充分利用原料的角度考虑,选用________(填序号)物质作原料较好.
A.CO B.石脑油(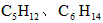 ) C. ) C.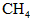 D.焦炭 D.焦炭
(2) 水解生成BiOCl沉淀.试回答下列问题: 水解生成BiOCl沉淀.试回答下列问题:
①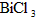 分解的反应方程式为____________________________________. 分解的反应方程式为____________________________________.
②医药上把BiOCl叫做交氯酸铋,分析这种名称是否合理:_______________.
③把适量的 溶于浓NaCl溶液中或溶于含有少量盐酸的水中都得到澄清溶液,试用平衡移动原理分析可能的原因____________________________________. 溶于浓NaCl溶液中或溶于含有少量盐酸的水中都得到澄清溶液,试用平衡移动原理分析可能的原因____________________________________.
参考答案:(1)B
(2)①![]() 本题解析: 本题解析:
本题难度:一般
4、选择题 0.1 mol / L Na2CO3和0.1 mol / L NaHCO3溶液的pH值比较(????)
A.大于
B.等于
C.小于
D.不能肯定
参考答案:A
本题解析:
试题分析:Na2CO3溶液中CO32?水解,NaHCO3溶液中HCO3?水解,CO32?的水解程度大于HCO3?的水解,所以0.1 mol / L Na2CO3溶液的pH大,故A项正确。
本题难度:一般
5、选择题 常温下,用 0.1 mol·L—1HCl溶液滴定10.0 mL浓度为0.1 mol·L—1 Na2CO3溶液,所得滴定曲线如图所示。下列说法正确的是
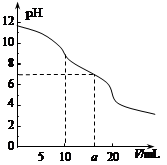
A.当V=0时:c(H+)+c(HCO 3-)+c(H2CO3)=c(OH-)
B.当V=5时:c(CO32—)+c(HCO 3-)+c(H2CO3)=2c(Cl-)
C.当V=10时:c(Na+)>c(HCO 3-)>c(CO32—)>c(H2CO3)
D.当V=a时:c(Na+)>c(Cl-)>c(H+)=c(OH-)
参考答案:BD
本题解析:
试题分析:A、溶液中氢氧根离子和氢离子均是水电离出来的,水电离出的氢离子和氢氧根离子相等,故c(H+)+c(HCO 3-)+2c(H2CO3)=c(OH-),故A错误;B、当V=5时,溶液中加入了0.005mol的氯离子,根据碳元素守恒可得,反应前和反应后溶液中均有n(CO32—)+n(HCO 3-)+n(H2CO3)=0.001mol,故三者的物质的量之和与氯离子的物质的量之比为2:1,故浓度之和等于氯离子浓度之和得2倍,故B正确;C、当V=10时,碳酸钠和盐酸恰好完全反应生成碳酸氢钠,在碳酸氢
本题难度:一般
|