微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 2010年诺贝尔化学奖授予理查德·赫克等三位科学家,以表彰他们在“钯催化交叉偶联”方面的研究。下面关于催化剂的说法正确的是
A.催化剂不能改变反应物的转化率
B.催化剂通过升高反应的活化能来加快反应速率
C.催化剂能够改变反应的反应热
D.催化剂只改变反应的正反应速率
参考答案:A
本题解析:
试题分析:催化剂通过降低反应的活化能来加快化学反应速率,它不能改变反应的反应热,也不能改变反应物的转化率,同等程度的加快正、逆反应速率,选A。
考点:考查催化剂的概念与性质。
本题难度:一般
2、选择题 已知:2M(g)?N(g);△H<0.现将M和N的混和气体通入体积为1L的恒温密闭容器中,反应体系中物质浓度随时间变化关系如图所示.下列说法正确的是( )

A.a、b、c、d四个点中处于平衡状态的点是a、b
B.反应进行至25min时,曲线发生变化的原因是加入了0.4molN
C.若40min后出现如图所示变化,则可能是加入了某种催化剂
D.若调节温度使35min时体系内N的百分含量与15min时相等,应升高温度
参考答案:由图象可知,10min达平衡时,标有b、d点的曲线物质的物质
本题解析:
本题难度:一般
3、选择题 影响化学反应速率的因素有多方面,如浓度。压强。温度。催化剂等。下列有关说法不正确的是
A.改变压强能改变气体反应的速率
B.增大浓度能加快化学反应速率,原因是增大浓度就增加了反应体系中活化分子的百分数
C.温度升高使化学反应速率加快的主要原因是增加了反应体系中活化分子的百分数
D.催化剂能加快化学反应速率主要原因是降低反应所需的能量
参考答案:B
本题解析:
试题分析:A、改变压强能改变气体反应的速率,故A正确;B、浓度增大,活化分子百分数不变,增大单位体积内分子总数,增大加了单位体积内活化分子的数目,故B错误;C、升高温度,分子能量增大,则增大活化分子百分数,反应速率加快,故C正确;D、催化剂改变反应历程,降低反应的活化能,降低反应所需的能量,反应速率加快,故D正确。
考点:本题考查化学反应速率的影响因素。
本题难度:一般
4、实验题 某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失快慢的方法,研究影响反应速率的因素。实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.010 mol·L-1、0.0010 mol·L-1,催化剂的用量可选择0.5 g、0 g,实验温度可选择298 K、323 K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.10 mol·L-1)的用量均为2 mL。
⑴ 请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
实验
编号
| T/K
| 催化剂的用量 / g
| 酸性KMnO4溶液的浓度/mol·L-1
| 实验目的
|
①
| 298
| 0.5
| 0.010
| a. 实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响;
b. 实验①和???探究温度对该反应速率的影响;
c. 实验①和??探究催化剂对该反应速率的影响。
|
②
| ?
| ?
| ?
|
③
| ?
| ?
| ?
|
④
| ?
| ?
| ?
⑵ 某同学对实验①和②分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
实验编号
| 溶液褪色所需时间 t / min
| 第1次
| 第2次
| 第3次
| ①
| 14.0
| 13.0
| 11.0
| ②
| 6.0
| 7.0
| 7.0
① 实验②中用KMnO4的浓度变化来表示的平均反应速率为???????????(忽略混合前后溶液的体积变化)。
② 该同学分析上述数据后得出“当其他条件相同的情况下,酸性KMnO4溶液的浓度越小,所需要的时间就越短,亦即其反应速率越快”的结论,你认为是否正确???????(填“是”或“否”)。他认为不用经过计算,直接根据表中褪色时间的长短就可以判断浓度大小与反应速率的关系,你认为是否可行????????(填“是”或“否”),若不可行(若认为可行则不填),请设计可以直接通过观察褪色时间的长短来判断的改进方法:?????????????????????????????????????????????????????????????????????。
参考答案:⑴
实验
编号
T/K
催化剂的用量
本题解析:(1)考查外界条件对反应速率的影响。要探究温度对该反应速率的影响,则催化剂的量和高锰酸钾溶液的浓度应该是相同的。而要究催化剂对该反应速率的影响,则温度和高锰酸钾溶液的浓度是相同的,所以答案是
实验
编号
T/K
催化剂的用量 / g
酸性KMnO4溶液的浓度/mol·L-1
实验目的
①
?
?
?
a. 实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响;
b. 实验①和 ③ 探究温度对该反应速率的影
本题难度:一般
5、选择题 可逆反应mA(g)+nB(s) rC(g)+qD(g)在反应过程中,其他条件不变,D的体积百分含量和温度T或压强P关系如图所示,下列叙述中正确的是 rC(g)+qD(g)在反应过程中,其他条件不变,D的体积百分含量和温度T或压强P关系如图所示,下列叙述中正确的是
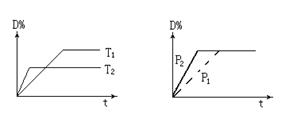
A.化学方程式系数m+n=r+q
B.使用催化剂,D的物质的量分数增加
C.温度降低,化学平衡向正反应方向移动
D.物质B的颗粒越小,反应越快,有利于平衡向正反应方向移动
参考答案:C
本题解析:
试题分析:A.由右图可知,压强为P2先到达平衡,故P2>P1,增大压强,D%不变,则平衡不移动,反应中B为固体,故m=r+q,故A错误;B.使用催化剂,缩短到达平衡时间,平衡不移动,D%的不变,故B错误;C、由左图知,温度T2为先到达平衡,故T2>T1,升高温度,D%减小,则平衡向逆反应移动,因此温度降低,化学平衡向正反应方向移动,C正确;D.B为固体,物质B的颗粒越小,接触面积越大,反应越快,但对平衡移动没有影响,故D错误,故选C。
考点:考查化学平衡的移动、化学平衡影响因素、化学平衡图象等
本题难度:一般
|
|