微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 工业上将纯净干燥的氯气通入到物质的量浓度为0.375?mol/LNaOH溶液中得到漂白液。某同学想在实验室探究Cl2性质并模拟制备漂白液,下图是部分实验装置。已知KMnO4与盐酸溶液反应可以制取Cl2。
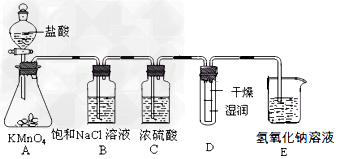
⑴配制450?mL物质的量浓度为0.375?mol/LNaOH溶液时,主要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒和__________。
⑵浓硫酸的作用是____________________。
⑶装置E中发生化学反应的离子方程式为____________________。
⑷装置B中饱和NaCl溶液可用于除去Cl2中的HCl气体,已知氯气与水的反应是一个可逆反应,请简述饱和NaCl溶液除去Cl2中HCl气体的原理(用离子方程式表示和文字说明)
____________________。
⑸实验时装置D中湿润的红色纸条褪色,干燥部分没有褪色,放置一段时间后,纸条全部褪色。该同学认为Cl2的密度比空气大,可能是试管下部Cl2的浓度大于试管上部Cl2的浓度所导致的。请判断该解释是否合理,并分析产生上述实验现象的原因_______________;如需改进,请简述设计方案______________(若认为合理。则此问可不作答)。
⑹氯元素含量为10%的漂白液355?g,其中含NaClO的物质的量为_________mol。
参考答案:⑴500 mL容量瓶
⑵干燥氯气
⑶Cl2 +
本题解析:
本题难度:一般
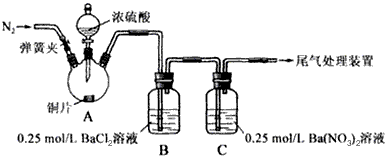
2、实验题 甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。
|
实验操作和现象
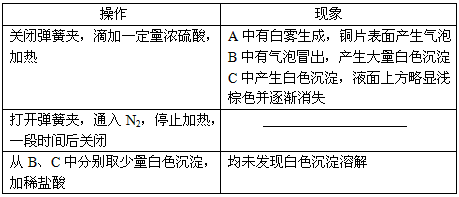
⑴A中反应的化学方程式是_______________。
⑵C中白色沉淀是__________,该沉淀的生成表明SO2具有____________性。
⑶C中液面上方生成浅棕色气体的化学方程式是____________________________。
⑷分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。
①为证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是______________;乙在A、B间增加洗气瓶D,D中盛放的试剂是______________。
②进行实验,B中现象
检验白色沉淀,发现均不溶于稀盐酸。结合离子方程式解释实验现象异同的原因:______________。
⑸合并⑷中两同学的方案进行实验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是____________________________。
参考答案:⑴Cu+2H2SO4![]() 本题解析:
本题解析:
本题难度:困难
3、实验题 (15分)氰化物有剧毒,冶金工业会产生大量含氰化物的废水,其中氰化物以CN—等形式存在于废水中。某化学小组同学对含氰化物废水处理进行研究。
I.查阅资料:含氰化物的废水破坏性处理方法。
利用强氧化剂将氰化物氧化为无毒物质,如以TiO2为催化剂用NaClO将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等。
II.实验验证:破坏性处理CN-的效果。
化学兴趣小组的同学在密闭系统中用图10装置进行实验,以测定CN-被处理的百分率,实验步骤如下:
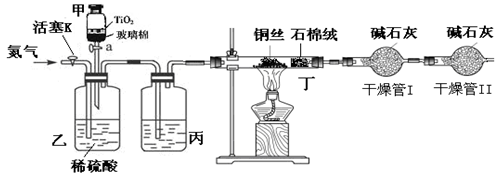
步骤1:取一定量废水进行加热蒸发、浓缩。
步骤2:取浓缩后含CN-离子的废水与过量NaClO溶液的混合液共200mL(设其中CN-的浓度为0.2mol·L—1)倒入甲中,塞上橡皮塞。
步骤3:????????????????????????????????????
步骤4:打开甲上的橡皮塞和活塞,使甲中溶液全部放入乙中,关闭活塞。
步骤5:打开活塞K,通一段时间N2,关闭活塞K。
步骤6:实验完成后测定干燥管I(含碱石灰)的质量m2(实验前干燥管I(含碱石灰)的质量m1)
回答下列问题:
(1)在破坏性处理方法中,在酸性条件下NaClO和CNO-反应的离子方程式???????。
(2)完成步骤3?????????????。
(3)丙装置中的试剂是??????????,丁装置的目的是??????????????。
(4)干燥管Ⅱ的作用是????????????????????。
(5)请简要说明实验中通入N2的目的是?????????????。
(6)若干燥管Ⅰ中碱石灰增重1.408g,则该实验中测得CN-被处理的百分率为??????。
参考答案:(1)2CNO—+6ClO—+8H+=2CO2↑+N2↑+C
本题解析:(1)次氯酸钠具有强氧化性,能把CNO—氧化生成氮气和CO2,所以反应式为2CNO—+6ClO—+8H+=2CO2↑+N2↑+Cl2↑+4H2O。
(2)由于需要通过加热的铜丝吸收氯气,所以应该先点燃丁处的酒精灯。
(3)因为生成的气体需要干燥,所以丙装置中应该盛放浓硫酸,干燥CO2气体。
(4)干燥管I是吸收CO2的,因此为了防止空气中的水和CO2进入干燥管I中影响对CO2的测量,需要再连接1个干燥管。
(5)由于装置中会残留部分CO2,所以通入氮气的目的是使装置中的CO2全部到干燥管I中被吸收,减少误差。
(6)干燥管Ⅰ中碱石灰增重1.408g,则反应中生成的CO2是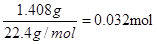 ,所以CNO—的物质的量是0.032mol。CN-的总的物质的量是0.04mol,所以根据原子守恒可知,该实验中测得CN-被处理的百分率为80%。
,所以CNO—的物质的量是0.032mol。CN-的总的物质的量是0.04mol,所以根据原子守恒可知,该实验中测得CN-被处理的百分率为80%。
本题难度:一般
4、填空题 工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)制取金属锌的流程如图所示。回答下列问题:
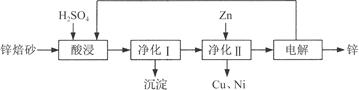
(1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为___________。
(2)净化Ⅰ操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀。
①写出酸性条件下H2O2与Fe2+反应的离子方程式:___________。
②25 ℃时,pH=3的溶液中,c(Fe3+)=________mol·L-1(已知25 ℃,Ksp[Fe( OH)3]=4.0×10-38)。
③净化Ⅰ生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是____________________。
(3)若没有净化Ⅱ操作,则对锌的制备带来的影响是_________________。
⑷本流程中可以循环利用的物质除锌外还有________________。
参考答案:(13分,第(1)小题3分,其余每空2分)
(1)Zn
本题解析:(1)根据信息,酸浸时ZnFe2O4会生成两种盐,这两种盐分别为硫酸锌、硫酸铁,即ZnFe2O4与硫酸反应生成硫酸锌、硫酸铁,反应的化学方程式为:ZnFe2O4+4H2SO4═ZnSO4+Fe2(SO4)3 +4H2O,
答案为:ZnFe2O4+4H2SO4═ZnSO4+Fe2(SO4)3 +4H2O;
(2)①亚铁离子被双氧水氧化成铁离子,反应的离子方程式为H2O2+2Fe2++2H+═2Fe3++2H2O,答案为:H2O2+2Fe2++2H+═2Fe3++2H2O;
②氢氧化铁的溶度积Ksp[Fe(OH)3 ]=4.0×10-38,pH=3的溶液中,氢氧根离子的浓度为1×10-11mol·L-1,c(Fe3+)= mol·L-1=4.0×10-5mol·L-1,
mol·L-1=4.0×10-5mol·L-1,
答案为:4.0×10-5;
③由于生成的Fe(OH)3胶体(沉淀)具有吸附性,所以净化Ⅰ生成的沉淀中还含有溶液中的悬浮杂质,答案为:Fe(OH)3胶体(沉淀)具有吸附性;
(3)由于锌焙砂中含有CaO、FeO、CuO、NiO等氧化物,反应后溶液中存在铜离子,没有净化Ⅱ操作,电解制取的锌中会含有铜等杂质,答案为:制取的锌含铜等杂质;
(4)通过制取金属锌的流程图示可以知道,可以循环利用的物质除锌外,含有硫酸、硫酸锌,
答案为:H2SO4、ZnSO4.
本题难度:一般
5、选择题 下列实验操作或描述中正确的是(??)
①将NaNO3和KCl的混合液加热并浓缩至有晶体析出,趁热过滤时,可分离出NaCl晶体
②海带中碘元素的分离及检验时,需要向海带灰的浸取液中加入少量稀硫酸和过氧化氢溶液
③纸层析法分离铁离子和铜离子实验中,点样后的滤纸需晾干后,才能将其浸入展开剂中
④经氯气消毒的自来水,若用于配制Na2CO3溶液和FeSO4溶液均会使所配溶液变质
⑤用加热法可以分离高锰酸钾和碘单质的混合物,因为碘单质受热易升华
⑥配制一定物质的量浓度的溶液时,将量取液态物质的量筒用水洗涤,洗涤液倒入容量瓶
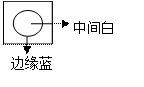
⑦将饱和氯水滴到淀粉碘化钾试纸上出现如图现象,说明低浓度氯水能将I-氧化成I2,高浓度氯水能将I2进一步氧化成碘的化合物
⑧将过量CO2通入Ca(ClO)2溶液得澄清溶液,说明H2CO3的酸性比HClO弱
A.③⑤⑥⑦⑧
B.①②④⑦
C.①②④⑥⑦
D.③④⑥⑧
参考答案:B
本题解析:略
本题难度:简单