微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (6分)处理含CN-(其中C为+ 2价)的工业废水常用Cl0_氧化,生成的CNO (其中C为+4价),反应的离子方程式为: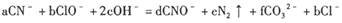
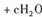 ,上述离子方程式可能的配平系数有多组。请回答:
,上述离子方程式可能的配平系数有多组。请回答:
(1)??该离子方程式中e:f的值是________(填选项标号)。
A.0.5
B.1
C.2
D.不能确定
(2)??若d="e" =l,则b=________
(3)若反应中转移1.2mol电子,则生成的气体在标况的体积是________。
参考答案:(1)A?(2)6???(3)2.24L
本题解析:(1)由C原子守恒知:a=d+f???由N原子守恒知:a=d+2e
故f=2e,即e:f=1/2=0.5
(2)若d="e" =l,由a=d+2e知,a=3,再由a=d+f知,f=2
由化合价的升降守恒知:2b=2d+6e+2f,知b=6
(3)当有1mol氮气生成时,转移的电子为12mol,故若反应中转移1.2mol电子,则生成的气体在标况的体积是0.1×22.4=2.24L
本题难度:一般
2、选择题 江苏中国矿业大学一名大学生用铊盐进行投毒事件,引起警方高度重视。铊(TI)的毒性高于铅和汞,在生产鞭炮(花炮)的原料中往往也含有高量的铊元素,长时间在鞭炮爆炸物氛围中也会引起中毒。铊属ⅢA族元素。下列推断或说法不正确的是??(???)
A.以惰性电极电解TlCl3溶液可得到金属铊
B.铊盐对环境有危害,对水体可造成污染
C.铊的电负性比铝小
D.同物质的量浓度时AlCl3水溶液酸性比TlCl3强
参考答案:A
本题解析:
本题难度:简单
3、选择题 用水热法制备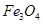 纳米颗粒的总反应如下: 纳米颗粒的总反应如下:
3 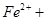 ? ?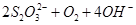 === ===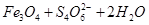 。下列说法正确的是 。下列说法正确的是
A.在反应中硫元素被氧化,铁元素被还原
B.还原剂是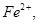 氧化剂是 氧化剂是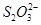 和 和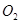
C.每生成1 mol 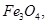 转移3 mol电子 转移3 mol电子
D.当转移1 mol电子时,消耗56 g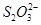
参考答案:D
本题解析:根据方程式可知,铁元素的化合价从+2价部分升高到+3价,失去电子,被氧化,A不正确;硫元素的化合价从+2价升高到+2.5价,失去电子被氧化,作还原剂,B不正确;氧气中氧元素的化合价从0价降低到-2价,得到电子,被还原,作氧化剂,反应中转移4个电子,所以C不正确,D正确,答案选D。
本题难度:一般
4、选择题 Ag2 Se单晶呈六角微型管状,有望开发为新型材料,其制取原理为:4AgCl+3Se +6NaOH????2Ag2Se+ Na2SeO3+4NaCl+3H2O
关于该反应下列叙述正确的是?????????????????(???)
A.AgCl作氧化剂
B.6mol NaOH参加反应转移6mol e-
C.被还原硒与被氧化硒的质量比为1:2
D.被还原硒与被氧化硒的物质的量之比为2:1
参考答案:D
本题解析:
试题分析:A、AgCl化合价没有发生变化,不是氧化剂、还原剂,故错;B、6mol NaOH参加反应转移的是4mol e-,故错;C、被还原硒与被氧化硒的质量比为2:1,故错。故选D。
点评:本题考查氧化还原反应的特征和有关的概念内涵,要求学生具有分析和解决问题的能力,注意反应中只有一种元素化合价变化时的情况,难度较大。
本题难度:一般
5、简答题 钛(Ti)具有高强度和耐酸腐蚀性,是重要的工业原料.以金红石(主要成分为TiO2,含少量Fe2O3、SiO2)为原料可制取Ti.工业流程如下:
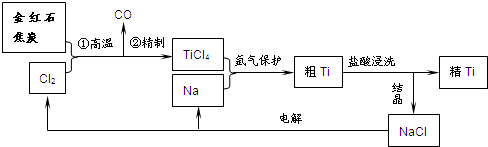
(1)粗TiCl4中含有少量FeCl3、SiCl4等,它们的部分性质如下:
| 物质 | 沸点/°C | 在水中 | ?在乙醚中
?TiCl4
??136
强烈水解
??易溶
?SiCl4
??58
?强烈水解
??易溶
?FeCl3
??303(升华)
水解
??易溶
从粗TiCl4中精制TiCl4的方法是______???A.用水溶解后,重结晶???B.蒸馏???C.用乙醚萃取后,分液
(2)写出金红石高温反应制取TiCl4的化学方程式______.
(3)写出电解熔融NaCl的化学方程式______;阴极产物是______.
(4)粗钛产品粉碎后要用盐酸浸洗.其主要目的是______.
(5)Ti可溶解在浓HF溶液中,请完成下列离子方程式.______Ti+______HF-______TiF62-+______+______H2↑
参考答案:(1)粗TiCl4中加热易气化,与固体混合物可用分馏的方法分
本题解析:
本题难度:一般
|
|