微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 a mol Cu与含b mol HNO3的溶液恰好完全反应,被还原的HNO3的物质的量一定是(???? )
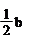
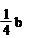
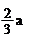
A.(b-2a) mol
B. mol
C. mol
D. mol
参考答案:A
本题解析:根据原子守恒可知,生成硝酸铜是amol,所以没有被还原的硝酸是2amol,因此被还原的硝酸是(b-2a) mol ,答案选A。
本题难度:一般
2、选择题 用48mL0.1mol/L的FeSO4溶液,恰好还原2.4×10-3mol[RO(OH)2]+?离子,则R元素的最终价态为
A.+2
B.+3
C.+4
D.+5
参考答案:B
本题解析:二者的物质的量比为2:1,+2价铁升高2价,所以R的化合价应从+5降至+3。
本题难度:一般
3、填空题 铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 Fe3O4+6SO2,有3mol FeS2参加反应,转移?????????????mol电子。
Fe3O4+6SO2,有3mol FeS2参加反应,转移?????????????mol电子。
(2)FeCl3溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为????????????????????;从腐蚀废液回收得到金属铜,还需要的试剂是????????????????。
(3)与明矾相似,Fe2(SO4)3也可用作净水剂,在使用时发现Fe2(SO4)3并不能使酸性废水中的悬浮物沉降除去,其原因是???????????????????????????????????????????????????????????????????????。
(4)钢铁的电化学腐蚀简单示意图如下,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在下图虚线框中作出修改,并用箭头标出电子流动的方向。
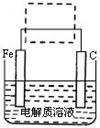
参考答案:(1)32
(2)2Fe3++Cu=2Fe2++Cu2
本题解析:
试题分析:(1)反应中FeS2中铁与硫的化合价均升高,氧气化合价下降,可以根据化合价升高总数也可以根据化合价降低总数计算转移电子数,3mol FeS2参加反应,转移电子数为8×4=32mol;(2)从腐蚀液中回收铜应采用置换法,有足量铁置换,再用稀硫酸除去铜中的铁;(3)Fe2(SO4)3可用作净水剂,是源于其水解产生氢氧化铁胶体,但酸性废水抑制Fe3+ 的水解,使其不能生成有吸附作用的Fe(OH)3胶体,故不能除去悬浮物;(4)该图所示铁的电化学防腐应为采用外加电源的电化学防腐,铁应与电源的负极
本题难度:困难
4、选择题 a、b、c、d分别是Cu、Ag、Fe、Al四种金属中的一种,已知:(1)b、c用导线相连插入稀硫酸溶液中,b表面上有气泡产生;(2)b与d的硝酸盐反应能置换出单质d;(3)a与强碱反应放出气体。由此可判断a、b、c、d依次为???(???)
A.Fe、Ag、Al、Cu、
B.Al、Fe 、Cu、Ag
C.Al、Cu、Fe、Ag
D.Fe、Ag、Cu、Al
参考答案:C
本题解析:由题目所给信息可判定金属活泼性顺序为:c>b、b>d;a为铝,则四金属分别为Al、Cu、Fe、Ag,答案为C
本题难度:简单
5、填空题 钙是自然界存在最广泛的IIA族元素,常以化合物N存在。从钙单质起始发生的一系列化学反应可由下图表示:
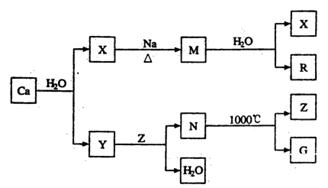
(1)钙元素在周期表中位于第______周期;Y中存在的化学键类型为_______________;N的化学式是______________。
(2)M与水反应的化学方程式为______________________________________________.
(3)Z和G的电子式分别为_______________________和_________________________.
(4)Z与R反应可能生成的盐有________________________________(填化学式)。
(5)实际生产中,可由N为原料制备单质钙,简述一种制备方法:
_________________________________________________________________________.
(6)金属钙线是炼制优质钢材的脱氧脱磷剂。某钙线的主要成分含Fe元素和Ca元素。
请配平下列用钙线脱氧脱磷的化学方程式: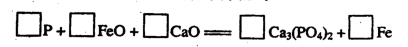
参考答案:
(1)4???离子键、共价键???? CaCO3
本题解析:
试题分析:根据流程信息分析,X、Y、M、N、R、Z、G分别为H2、Ca(OH)2、NaH、CaCO3、NaOH、CO2、CaO。(3)CO2与NaOH反应,足量生成NaHCO3,少量生成Na2CO3;(4)活泼金属的制备如Na、K、Mg、Al等,采用电解法,一般电解熔融氯化物(铝例外)
本题难度:一般