微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s) + 3O2 (g) = 2Cu2O(s) + 2SO2(g)?△H=-768.2kJ·mol-1,①
2Cu2O(s) + Cu2S(s) =" 6Cu(s)" + SO2(g)???△H=+116.0kJ·mol-1,②
①热化学方程式:Cu2S(s) + O2(g) =" 2Cu(s)" + SO2(g) △H= kJ·mol-1。
②获得的粗铜需电解精炼,精炼时粗铜作 极(选填:“阳”或“阴”)。
(2)氢化亚铜是一种红色固体,可由下列反应制备
4CuSO4 + 3H3PO2 + 6H2O =" 4CuH↓" + 4H2SO4 + 3H3PO4?。
①该反应还原剂是 (写化学式)。
②该反应每转移3 mol电子,生成CuH的物质的量为 。
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如图。

①当c(Cl-)="9" mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为 。
②在c(Cl-)="1" mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为 (任写一个)。
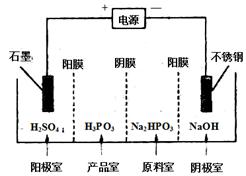
(4) 电解Na2HPO3溶液可得到亚磷酸,装置如图(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过)
①阳极的电极反应式为____________________。
②产品室中反应的离子方程式为____________。
参考答案:(16分)(1)①Cu2S(s)+O2(g)=2Cu(s)+
本题解析:
试题分析:(1)①根据盖斯定律可得Cu2S(s) + O2(g) =" 2Cu(s)" + SO2(g) △H=(①+②)/3=(-768.2kJ·mol-1+116.0kJ·mol-1)/3=-217.4KJ/mol;
②粗铜精炼时,粗铜作阳极,纯铜作阴极;
(2)①根据还原剂的判断,元素化合价升高的物质作还原剂,在4CuSO4 + 3H3PO2 + 6H2O =" 4CuH↓" + 4H2SO4 + 3H3PO4?中P元素的化合价升高,所以还原剂是H3PO2;
②该反应中每生
本题难度:一般
2、选择题 在一定条件下,RO3n-和I-可发生如下反应:RO3n-+6I-+6H+=R-+3I2+3H2O,则RO3n-中R元素的化合价为(??)
A.+1
B.+3
C.+5
D.+7
参考答案:C
本题解析:
试题分析:首先利用离子反应中电荷守恒先求出n的值。N+6-6=-1解得 n=1.然后利用在氧化还原反应中电子得失守恒。设R的化合价为+χ。1×(χ+1)=6×1,解得+χ=+5。所以正确选项为:D.
考点:电荷守恒,电子得失守恒等守恒的知识。
本题难度:一般
3、填空题 亚硝酸钠(NaNO2)又称工业盐,其外观类似食盐,但有剧毒.近年来,建筑工地多次发生民工误食工业盐而中毒的事件.利用如下反应可鉴别NaNO2和NaCl.
______KMnO4+______NaNO2+______H2SO4=______MnSO4+______K2SO4+______NaNO3+______H2O
(1)配平上述反应的化学方程式;
(2)指出该反应的氧化剂______;
(3)当有2mol氧化剂被还原时,则转移的电子是______mol.
参考答案:(1)该反应中,1mol高锰酸钾参加氧化还原反应得到4mol
本题解析:
本题难度:简单
4、选择题 火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2→Cu2S+2FeS+SO2下列说法正确的是
A.SO2只是氧化产物
B.CuFeS2仅作还原剂,硫元素被氧化
C.每生成1molCu2S,有4mol硫被氧化
D.每转移1.2mol电子,有0.2mol硫被氧化
参考答案:D
本题解析:依题意知,Cu从+2价降低为Cu2S中+1价,S从-2价升高到SO2中的+4价;氧元素化合价降低。SO2既是氧化产物又是还原产物;CuFeS2既是氧化剂又是还原剂;每生成1 molCu2S,有1mol硫被氧化。S元素由-2价升高到+4价,该反应中转移电子数是6,所以每转移1.2 mol电子,则有0.2 mol硫被氧化,故D正确;
本题难度:一般
5、选择题 已知双氧水仅发生:H2O2 O2。等物质的量浓度、等体积的氯化亚铁溶液、亚硫酸钠溶液、双氧水溶液、KI溶液,分别与足量的同浓度的酸性高锰酸钾溶液反应,消耗高锰酸钾溶液体积比为(???)
O2。等物质的量浓度、等体积的氯化亚铁溶液、亚硫酸钠溶液、双氧水溶液、KI溶液,分别与足量的同浓度的酸性高锰酸钾溶液反应,消耗高锰酸钾溶液体积比为(???)
A.1:2:1:2
B.1:2:2:2
C.1:2:2:1
D.2:1:1:2
参考答案:C
本题解析:Fe2+ Fe3+ :e- ?SO32-
Fe3+ :e- ?SO32- SO42- :2e-? H?2O2
SO42- :2e-? H?2O2 本题难度:一般
本题难度:一般