微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (10分)在实验室中学生用下左图装置制取乙酸乙酯。
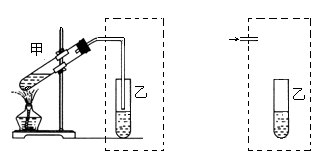
写出该反应的化学方程式______________________________。
回答下列问题:
(1)在大试管中加入浓硫酸3mL、冰醋酸3mL(3 g)、乙醇4mL(2.7 g),加入试剂的正确操作是__________________________________。
(2)装置中通蒸汽的导管只能插到饱和碳酸钠溶液的液面上方,不插入溶液中,作用是__________,长导管的作用是_______________。试设计另一个装置也能实现上述两个作用,在虚线部分画出该装置简图。
(3)试管乙中的现象是_______ ,由此可知乙酸乙酯的物理性质有_________________ 。
(4)充分反应后,制得乙酸乙酯的质量_______________g。
(5)工业用石油裂解气的主要成分为原料制取乙酸乙酯,经过的反应类型(按反应顺序)是_________________________。???????????
参考答案:CH3COOH+CH3CH2OH  本题解析:实验室制取乙酸乙酯用乙酸和乙醇作用,方程式为CH3COOH+CH3CH2OH
本题解析:实验室制取乙酸乙酯用乙酸和乙醇作用,方程式为CH3COOH+CH3CH2OH 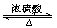 ?CH3COOC2H5+H2O
?CH3COOC2H5+H2O
(1)浓硫酸溶于水放出大量的热,且密度大于水的,所以应该是在试管中加4mL乙醇,然后边摇动试管边慢慢加入3mL浓硫酸和3mL 乙酸。
(2)挥发出来的乙酸和乙醇都是和水互溶的,如果直接插入溶液中,易倒吸。长导管能起导气和冷凝作用。要起以上的作用,可用竖直的干燥管即可,如图所示(见答案)。
(3)乙酸乙酯不溶于水,所以在饱和碳酸钠溶液的液面上有透明的油状液体产生,且可闻到香味。
(4)根据所给数据开始,理论上生成乙酸乙酯应该是3g+2.3g-0.9g=4.4g,但反应但可逆反应,所以实际生成的乙酸乙酯小于4.4g。
(5)裂解气中含有乙烯,乙烯和水加成即得到乙醇,乙醇氧化即得到乙酸,乙酸和乙醇酯化即生成乙酸乙酯。
本题难度:一般
2、选择题 下列实验中,由于错误操作导致所测出的数据一定偏低的是???(????)????
A.观察酸式滴定管液面时,开始俯视,滴定终点平视,所测出的碱液的浓度值
B.用标准盐酸滴定未知浓度的氢氧化钠溶液时,酸式滴定管洗净后,没有用标准盐酸润洗而直接装标准盐酸滴定碱液,所测出的碱液的浓度值
C.用已知浓度的盐酸溶液滴定未知浓度的氢氧化钠溶液用酚酞做指示剂所测出的碱液的浓度值
D.做中和热测定时,在大小两个烧杯之间没有垫碎泡沫塑料(或纸条)所测出的中和热数值
参考答案:D
本题解析:
试题分析:观察滴定管液面时,开始俯视、终点平视,则溶液体积偏大,所测碱液浓度偏大,A错误;盐酸滴定氢氧化钠溶液,酸式滴定管水洗后未用标准液润洗,则盐酸体积偏大,碱液浓度偏高,B错误;盐酸滴定氢氧化钠溶液用酚酞作指示剂所测碱液浓度无影响;测定中和热,大小烧杯间未垫碎泡沫塑料或纸条,则热量有损失,测得中和热数值偏低,D正确。
点评:酸碱中和滴定时,滴定管水洗后需用标准液润洗,锥形瓶水洗后不能用待装液润洗。
本题难度:简单
3、实验题 (12 分)以电石渣[主要成分是Ca(OH)2,含SiO2、Al2O3以及其它少量杂质]为原料生产氯酸钾联产碳酸钙的流程如下:
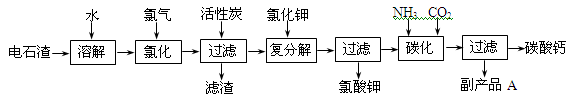
回答下列问题:
(1)电石渣溶于水形成电石渣浆时发生的主要反应的化学方程式为:
_____________________________________、__________________________________。
(2)氯化过程的温度控制在75~80℃,该过程主要反应的化学方程式为:
________________________________________________________________________。
(3)该流程中加入活性炭的作用是_____________________________________________。
(4)该流程中碳化反应的离子方程式为_________________________________________。
(5)副产品A的化学式为________________。
参考答案:(12分)
(1)Ca(OH)2 + SiO2 = C
本题解析:
试题分析:(1)SiO2、Al2O3都能与碱[Ca(OH)2]发生反应,方程式为:Ca(OH)2 + SiO2 = CaSiO3 + H2O ??Ca(OH)2 + Al2O3 = Ca(AlO2)2 + H2O。
(2)氯化过程是反应掉多余的Ca(OH)2,化学方程式为6Cl2 + 6Ca(OH)2 Ca(ClO3)2 + 5CaCl2 + 6H2O。
Ca(ClO3)2 + 5CaCl2 + 6H2O。
(3)氯气有毒,且活性炭具有吸附作用,故加入活性炭的作用是吸附氯气,防止在后续实验中氯气逸出污染环境。
点评:本题是有关实验方案的设计和评价的考查,要求学生熟悉所实验的内容及原理,能够考查同学们进行分析问题、解决问题的能力。
本题难度:一般
4、实验题 醛可与NaHSO3饱和溶液发生加成反应,生成水溶性的α-羟基磺酸钠:
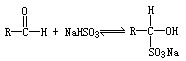
反应是可逆的。在通常条件下有70%~90%的原料向正反应方向转化。
(1)若氯苯中含有杂质苯甲醛,要除去此杂质,可作用的试剂是____,反应的化学方程式为:____;分离的方法是____。
(2)若使CH3—CHOH—SO3Na转化为乙醛,可采用的试剂是____,反应的化学方程式为____,分离的方法是____。
参考答案:
 本题解析:充分应用题给信息,并联想有关化学平衡移动的概念和物质的性质分析题目要求。
本题解析:充分应用题给信息,并联想有关化学平衡移动的概念和物质的性质分析题目要求。
(1)氯苯中混有苯甲醛,按题给反应,用NaHSO3与苯甲醛加成,生成可溶于水的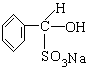 ,则与不溶于水的氯苯分为两层,用分液漏斗分离即可。反应的化学方程式为:
,则与不溶于水的氯苯分为两层,用分液漏斗分离即可。反应的化学方程式为:
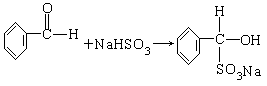
(2)注意到题给条件“反应是可逆的,在通常条件下”正反应方向的转化率较高,若能使平衡左移,则可生成乙醛,而考虑平衡左移的方法,若以CH3—CHOH—SO3Na为纯液体,没有浓度的问题,则只应考虑使左侧NaHSO3浓度减小的办法,则可相应使用H2SO4,发生反应:
2NaHSO3+H2SO4==Na2SO4+2H2O+2SO2↑
使NaHSO3浓度减小,而使平衡左移,转化为乙醛:

注意到Na2SO4为离子晶体,熔沸点较高,而CH3CHO沸点仅为20.8℃,易挥发,所以用蒸馏的方法,则可分离出乙醛。
本题难度:一般
5、选择题 下列各组气体中,在通常情况下既能用浓硫酸又能用碱石灰干燥的有(?????)
A.CO、O2、N2
B.HCl、Cl2、CO2
C.NH3、H2、CO
D.SO2、Cl2、O2
参考答案:A
本题解析:
试题分析:浓硫酸是强酸,还具有强氧化性,不能干燥氨气。碱石灰是氢氧化钠和生石灰的混合物,不能干燥酸性气体,例如氯化氢、氯气、CO2和SO2等,答案选A。
点评:该题是高考中的常见考点,属于基础性试题的考查。主要是考查学生对常见干燥剂以及气体性质的熟悉了解程度,旨在巩固学生的基础,提高学生的应试能力。
本题难度:简单