微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 古代铁器(埋藏在地下)在严重缺氧的环境中,仍然锈蚀严重(电化腐蚀)。原因是一种叫做硫酸盐还原菌的细菌,能提供正极反应的催化剂,可将土壤中的SO42-还原为S2-,该反应放出的能量供给细菌生长、繁殖之需。
①写出该电化腐蚀的正极反应的电极反应式:????????????????????????????
②文物出土前,铁器表面的腐蚀产物可能有(写化学式)???????????????????????
参考答案:①SO42-+8e-+ 4H2O=S2-+8OH-;②Fe
本题解析:根据题意可知,正极:SO42-+8e-+ 4H2O=S2-+8OH- ,负极:Fe-2e-=Fe2+ ,两极产物相遇,生成Fe (OH)2?? FeS。
本题难度:简单
2、选择题 某蓄电池放电、充电时反应为:Fe+ Ni2O3 +3H2O  Fe(OH)2 +2Ni(OH)2下列推断不正确的是(??)
Fe(OH)2 +2Ni(OH)2下列推断不正确的是(??)
A.放电时,Fe为正极,Ni2O3为负极
B.充电时,阴极上的电极反应式是:Fe(OH)2 +2e-→Fe+2OH-
C.放电时,负极上的电极反应式是:Ni2O3 +3H2O+2e-→2Ni(HO)2 +2OH-
D.该蓄电池的电极必须是浸在某种碱性电解质溶液中
参考答案:AC
本题解析:
试题分析:A、由放电时的反应可以得出铁做还原剂失去电子,Ni2O3做氧化剂得到电子,即正极为Ni2O3、负极为Fe,故A错误;
B、充电可以看作是放电的逆过程,即阴极为原来的负极,所以电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2,所以电池充电过程时阴极反应为Fe(OH)2+2e-=Fe+2OH-,故B正确;
C、根据总反应Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,可以判断出铁镍蓄电池放电时Fe作负极,发生氧化反应,为还原剂,失电子生成Fe2+,碱性电
本题难度:一般
3、选择题 按下图所示装置进行实验(其中C1、C2均是石墨电极),下列说法中正确的是??
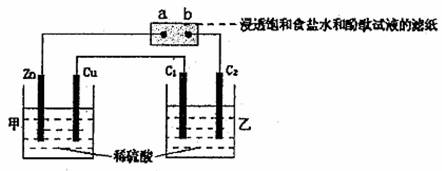
A.在通常状况下,Zn极减轻3.25g时,C2极上放出气体体积约为1.12L
B.发现b点附近显红色
C.在相同条件下,C1、C2电极所产生气体的体积比为2:1
D.乙池溶液的pH减小
参考答案:D
本题解析:由装置图知,甲池两极材料不同,Zn为活泼金属,∴甲为原电池,Zn为负极,Cu为正极,则a、C2为电解池的阴极,a极附近变红。B错。b、C1为阳极,乙池实质是电解水,则C1极放O2,C2极放H2,其体积比为1:2,C错。由于水被电解,C(H2SO4)增大,PH减小。选D。通常状况,气体的摩尔体积不是22.4L/mol,A错。
本题难度:一般
4、选择题 据环保部门测定,我国一些大城市的酸雨pH=3.5。在酸雨季节铁制品极易腐蚀,则在其腐蚀中正极发生的反应是 [???? ]
A.2H+?+?2e-=?H2↑?
B.2H2O?+?O2?+?4e-=?4OH-
C.Fe-2e-?=?Fe2+
D.4OH--4e-?=?2H2O?+?O2↑
参考答案:A
本题解析:
本题难度:简单
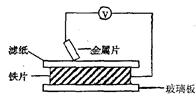
5、填空题 将洁净的金属片A、B 、C、D 分别放置在浸有盐溶液的滤纸上面并压紧(如图所示)。在每次实验时,记录电压指针的移动方向和电压表的读数如右表所示:
 ?
?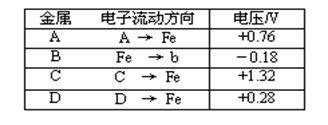
已知构成原电池两电极的金属活动性相差越大,电压表读数越大。请判断:
(1) A、B、C、D四种金属中活泼性最强的是_____________(用字母表示)
(2)若滤纸改用NaOH溶液浸润一段时间后,则在滤纸上能看到有白色物质析出,后迅速变为灰绿色,最后变成褐色。则滤纸上方的金属片为___________(A、B、C、D中哪一种),此时对应的电极反应式为:正极___________________________________________
参考答案:(1) C(2)B???? O2 + 2H2O + 4e-=
本题解析:(1)在原电池中,较活泼的金属作负极,失去电子,较不活泼的金属作正极。金属之间的活泼性相差越大,产生的电压越大。所以根据表中数据可知,金属性强弱顺序为C>A>D>Fe>B,所以金属性最强的是C。
(2)根据颜色的变化可知,最后生成的是氢氧化铁,这说明在反应中铁是负极,另一种是正极,因此应该是B。溶液显碱性,则发生吸氧腐蚀,正极反应式为O2 + 2H2O + 4e-=4OH-。
本题难度:一般