微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是[???? ]
A.苯中混有苯酚用溴水除去
B.将铁屑、溴水、苯混合制溴苯
C.用3mL乙醇、2mLH2SO4、2mL冰醋酸制乙酸乙酯,为增大反应速率,现改用6mL乙醇、4mLH2SO4、4mL冰醋酸
D.丙烷中混有乙烯不能用酸性高锰酸钾溶液除杂
参考答案:D
本题解析:
本题难度:一般
2、选择题 20℃时,NaCl的溶解度是36 g,此时NaCl饱和溶液的密度是1.12 g/cm3,此时NaCl饱和溶液中NaCl的物质的量浓度为
A.1.36 mol/L
B.5.07 mol/L
C.6.15 mol/L
D.0.15 g/mol
参考答案:B
本题解析:
本题难度:困难
3、选择题 下列说法正确的是( )
A.分离乙醇和乙酸乙酯的混合物,所用玻璃仪器为分液漏斗、烧杯
B.用如图所示装置分离CCl4萃取碘水后已分层的有机层和水层
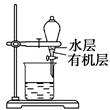
C.用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出
D.用如图所示装置除去乙醇中的苯酚
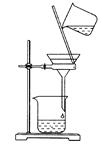
参考答案:B
本题解析:A项,乙醇与乙酸乙酯互溶,只使用分液漏斗无法分离,不能达到分离提纯的目的,错误;B项,CCl4的密度比水的大,位于水的下层,正确;C项,苯的密度比水的小,用苯萃取溴水中的溴时,含溴的苯溶液在上层,应将其从分液漏斗的上口倒出,错误;D项,苯酚易溶于乙醇等有机溶剂,不能用过滤的方法分离提纯,可用氢氧化钠溶液把苯酚变成苯酚钠,再蒸馏出乙醇的方法分离两者,错误。
本题难度:一般
4、简答题 工业上常利用低品位软锰矿浆(主要成分是MnO2)来吸收含SO2的废气,最终制得硫酸锰晶体(MnSO4·H2O),其主要流程如下:
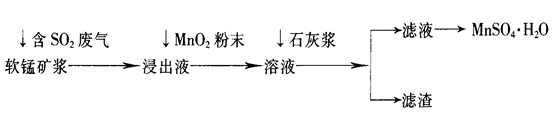
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子。有关金属离子形成氢氧化物沉淀时溶液的pH见下表:
离子
| 开始沉淀时的pH
| 完全沉淀时的pH
|
Fe2+
| 7.6
| 9.7
|
Fe3+
| 2.7
| 3.7
|
Al3+
| 3.8
| 4.7
|
Mn2+
| 8.3
| 9.8
?
(1)软锰矿浆中通入含SO2废气后,发生主要反应的化学方程式为____________________。
(2)浸出液中加入MnO2粉末的目的是____________;反应的离子方程式是___________________。
(3)溶液中加入石灰浆来调节pH,其作用是_________________;pH应调节的范围是__________。
(4)滤渣的主要成分是________________________________________________(用化学式表示)。
参考答案:(12分,每空2分)(1)SO2+MnO2=MnSO4?
本题解析:
试题分析:(1)低品位软锰矿浆的主要成分是MnO2,通入SO2浸出液的pH<2,其中的金属离子主要是Mn2+,这说明MnO2与SO2发生了氧化还原反应,反应的化学方程式为SO2+MnO2=MnSO4。
(2)杂质离子中Fe2+完全沉淀时的pH大于Mn2+开始沉淀时的pH,所以必须利用其还原性将其氧化成铁离子而除去。由于MnO2具有氧化性,能把亚铁离子氧化生成Fe3+,有关反应的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O。
(3)溶液的杂质离子Fe3+、Al3+阳离子,从图可表以看出,大于4.7可以将Fe3+和Al3+除去,但不能超过8.3,以防止Mn2+也沉淀,所以只要调节pH值在4.7≤pH<8.3间即可。
(4)Fe3+、Al3+等金属阳离子通过调pH值,转化为氢氧化铁、氢氧化铝沉淀,同时还生成微溶性的硫酸钙,所以滤渣主要有氢氧化铁、氢氧化铝、硫酸钙,其化学式分别是Fe(OH)3、Al(OH)3、CaSO4。
本题难度:一般
5、选择题 氯碱工业中,能穿过阳离子交换膜的是( )
A.Cl2
B.H2
C.Na+
D.OH
参考答案:选项中ABD中不是离子,只有选项C为金属阳离子,则能穿过阳离
本题解析:
本题难度:简单
|