微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 在如图所示的实验装置中,当A、B、C分别为以下不同组合时,回答有关问题。
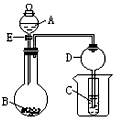
(1)当A为盐酸、B为贝壳(粉末)、C为水玻璃时,小试管中的现象是________________,其中发生的离子反应方程式是________________。
(2)当A为浓氨水、B为生石灰、C为AlCl3溶液,小试管中出现的现象是________________,反应的离子方程式为________________。
(3)当A为浓硫酸、B为Mg、Al、Fe、Cu中的一种银白色片状金属、C为品红溶液,小试管中溶液红色褪去,则B为 (填元素符号), A和B反应的方程式是________________。
(4)装置D的作用是________________。
2、实验题 某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用其产物进一步制取FeCl3·6H2O晶体(图中夹持及尾气处理装置均已略去)。

(1)装置B中发生反应的化学方程式为____ 。
(2)装置E中的现象是____ 。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,将滤液分成两份,分别检验滤液中的金属阳离子。检验Fe3+所用的试剂为___ 检验Fe2+所用的试剂为___。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下
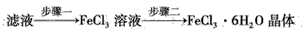
①步骤一中通入足量Cl2发生反应的离子方程式为___。
②步骤二从FeCl3溶液中得到FeCl3·6H2O晶体的主要操作如下(均在HCl气氛中进行): 蒸发、浓缩→冷却、结晶→过滤、洗涤、干燥 在蒸发皿中进行蒸发、浓缩操作时,当____时,应停止加热。此过程应保持盐酸过量的原因是___(用离子方程式表示)。
(5) FeCl3溶液可用于天然气脱硫,写出FeCl3溶液与天然气中的H2S反应的离子方程式:____。
3、填空题 工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾(?FeSO4?7H2O?).
(1)若用98%?1.84g/cm3的浓硫酸配制生产用28%的硫酸溶液,则浓硫酸与水的体积比约为1:______.
(2)为测定某久置于空气的绿矾样品中Fe2+的氧化率,某同学设计如下实验:取一定量的样品溶于足量的稀硫酸中,然后加入5.00g铁粉充分反应,收集到224mL(标准状况)气体,剩余固体质量为3.88g,测得反应后的溶液中Fe2+的物质的量为0.14mol(不含Fe3+).则该样品中Fe2+离子的氧化率为______.
(3)硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O](俗称莫尔盐),较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液.现取0.4g?Cu2S和CuS的混合物在酸性溶液中用40mL?0.150mol/L?KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O,6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O,反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与V?mL?0.2mol/L?(NH4)2Fe(SO4)2溶液完全反应.已知:MnO4-+Fe2++H+--Mn2++Fe3++H2O(未配平)①V的取值范围为______;②若V=35,试计算混合物中CuS的质量分数.
4、选择题 某学生在实验室制取乙酸丁酯(已知乙酸丁酯的沸点124~126℃,反应温度115~125℃),其反应装置应选择( )
A.

B.
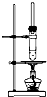
C.
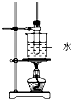
D.
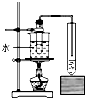
5、实验题 有甲、乙两位同学根据所学化学知识,设计了由铜和硫酸为原料制取硫酸铜的两种方案:
①铜与浓硫酸加热直接反应,即Cu→CuSO4
②将铜加到热的稀硫酸中并通入空气来制备硫酸铜,即由Cu→CuO→CuSO4,试回答:
(1)、写出方案①的化学反应方程式????????????????????????????????????????这两种方案,你认为哪一种方案比较合理?????????。(答编号),理由是??????????????????????????????????????????????????????????????????????
(2)、实验室采用方案①取6.4 g铜片和10 mL 18 mol/L-1浓硫酸,放在试管中共热时发现,铜与热的浓硫酸反应后并没有得到预期的蓝色溶液,而是在试管底部看到灰白色沉淀。甲、乙两位同学为了验证其中灰白色沉淀的主要成分,设计下列实验:实验步骤:倾倒掉上层液体后,向所得灰白色的固体中加入适量蒸馏水,边加边搅拌
实验现象:_____________________________________________
实验结论:所得灰白色固体的化学式为_????_______直到最后反应完毕,发现试管中还有铜片剩余。可两位同学仍然认为试管中还有硫酸剩余,他们这样认为的理由是___________??????????????????????_____