微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 NaClO2用于棉、麻、粘胶纤维及织物的漂白。实验室制备NaClO2的装置如下图所示:

(1)装置I控制温度在35~55℃,通入SO2将NaClO3还原为ClO2(沸点:11℃),反应结束后通入适量的空气,其目的是____________________。
(2)装置Ⅱ中反应生成NaClO2的化学方程式为_______________。反应后的溶液中阴离子除了OH-外还可能含有的一种不含氯元素的阴离子是_______,检验该离子的方法是_______。
(3)已知在NaClO2饱和溶液中,温度低于38℃时析出的晶体是NaClO2·3H2O,温度高于38℃时析出的晶体是NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl。请补充从装置Ⅱ反应后的溶液中获得NaClO2晶体的操作步骤:
①减压,55℃蒸发结晶;②___________;③__________;④__________;⑤得到成品。
(4)装置Ⅲ中试剂X为______________。
2、简答题 “酒是陈的香”就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室和工业上常采用如下反应:CH3COOH+C2H5OH?CH3COOC2H5+H2O来制取乙酸乙酯.
(1)实验时,试管B观察到的现象是界面处产生浅红色,下层为蓝色,振荡后产生气泡,界面处浅红色消失,原因是(用化学方程式表示)______.欲从上述混合物中分离出乙酸乙酯,采用的分离方法是______(填操作名称).
(2)事实证明,此反应以浓H2SO4为催化剂,也存在缺陷,其原因可能是______.
a.浓H2SO4易挥发,以至不能重复使用b.会使部分原料炭化
c.浓H2SO4有吸水性 d.会造成环境污染.
3、实验题 某化学实验小组制备硫酸亚铁铵晶体并设计实验测定其组成,他们进行了以下实验:
I?.向FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到一种浅蓝绿色的硫酸亚铁铵晶体,这种晶体俗名“摩尔盐”,它比绿矾稳定得多。将摩尔盐低温烘干后,称取7.84?g加热至1000C失去结晶水,质量变为5.68?g
II.?选择下图所示的部分装置连接起来,检查气密性后,将上述5.68g固体放入A装置的锥形瓶中,再向锥形瓶中加入足量NaOH浓溶液,充分吸收产生的气体并测出气体质量为0.68?g。

III.?向A中加入适量3%的H2O2溶液,充分振荡后滤出沉淀,洗净、干燥、灼烧后,测得其质量为1.6?g。
根据上述实验回答下列问题:
(1)?实验I中,要检验FeSO4溶液中是否含有Fe3+常用的试剂是_______,“一系列操作”依次为_______、_______和过滤。
(2)?实验II中,选择的装置是A接_______接_______(填代号),A装置中未使用分液漏斗的理由是______________
(3)?向锥形瓶中加入NaOH溶液的操作方法是_______,吸收A中产生的气体所用试剂应是_______?.实验小组的同学为保证A中产生的气体被完全吸收,以准确测量其质量,他们在A中反应停止后再进行的操作是______________。
(4)?根据上述实验数据计算,7.84g摩尔盐中SO42-的质量为_______g,摩尔盐中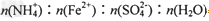 ?=_______
?=_______
4、实验题 实验室用图示装置制取乙酸乙酯。
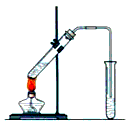
(1)浓H2SO4的作用是:①_____________,②_____________。
(2)右边收集试管内装有_____________,该溶液的作用是_____________________________________。 导气管不能插入液面以下,原因是_____________。加热前,大试管中加入几粒碎瓷片的作用是___________________________。
(3)制取乙酸乙酯的反应方程式是________________________。
(4)实验室可用乙醇来制取乙烯,将生成的乙烯通入溴的四氯化碳溶液,反应后生成物的结构简式是
_________________。
5、实验题 实验室制取乙酸乙酯的实验装置如下图所示。请回答下列问题。
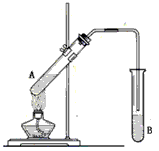
(1)加热前在A试管中加 ___________,其作用是防止加热过程中液体爆沸。 试管B内盛放的液体是_________ 碳酸钠溶液的作用是___________
(2)A中反应的化学方程式为 __________________。
(3)反应结束后,试管B内的液体分成两层,乙酸乙酯在_________ 层(填写“上”或“下”)。