微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (I)一定温度下,向Na2CO3溶液中加入BaCl2和K2SO4,当两种沉淀共存时,
C(CO32-)/C(SO42-)=?????????。[已知KspBaSO4=1.3ⅹ10-10,KspBaCO3=2.6ⅹ10-9]
(II)联氨(N2H4)及其衍生物是一类重要的火箭燃料,N2H4与N2O4反应能放出大量的热。
(1)已知:2NO2(g) N2O4(g)? ?H =-57.20 kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g)
N2O4(g)? ?H =-57.20 kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g) N2O4(g)达到平衡。其它条件不变时,下列措施能提高NO2转化率的是????????????。
N2O4(g)达到平衡。其它条件不变时,下列措施能提高NO2转化率的是????????????。
A.减小NO2的浓度
B.降低温度
C.增加NO2的浓度
D.升高温度
(2)25 ℃时,1.00 g N2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14 kJ的热量。则反应2N2H4(l)+N2O4(l) = 3N2(g)+4H2O(l)的?H =?????????kJ·mol-1。
(3)? 17 ℃、1.01×105 Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,
c(NO2) =" 0.0300" mol·L-1、c(N2O4) =" 0.0120" mol·L-1。 则反应2NO2(g) N2O4(g)的
N2O4(g)的
平衡常数K =????????。
(4)现用一定量的Cu与足量的浓HNO3反应,制得1.00 L已达到平衡的N2O4和NO2混合气体(17 ℃、1.01×105 Pa),理论上至少需消耗Cu?????????克。
参考答案:(I)20???(Ⅱ)?? (1)BC???????????
本题解析:略
本题难度:简单
2、计算题 以白云石(化学式表示为MgCO3·CaCO3)为原料制备Mg(OH)2的工艺流程如下图所示。
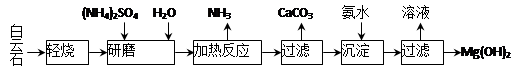
(1)研磨的作用是???????????????????。
(2)该工艺中可循环使用的物质是?????????????、??????????(写化学式)。
(3)白云石轻烧的主要产物是MgO·CaCO3,而传统工艺是将白云石加热分解为MgO和CaO后提取,白云石轻烧的优点是???????????????????????????????????????????????。
(4)加热反应的离子方程式为???????????????????????????????????????????????????。
(5)①加热反应时,在323k和353k溶液中c(NH4+)与反应时间的关系如下图所示,请在下图画出373k的曲线。
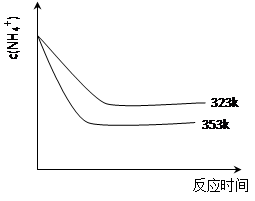
②由图可知,随着温度升高:?????????????????。
参考答案:(1)增大固体的表面积,加快反应速率,增大原料利用率
本题解析:(1)研磨的作用主要从对反应速率和原料的利用率角度分析,可以增大固体的表面积,加快反应速率,增大原料利用率;
(2)图中加热反应时放出氨气,而沉淀反应时加入氨水,因此可以将氨气循环利用,图中研磨时需要加入硫酸铵和水,而过滤时得到的溶液中含有硫酸铵,因此可以将硫酸铵循环利用;
(3)依题意,轻烧时只有碳酸镁分解,而碳酸钙不分解,由于二者的分解反应都是吸热反应,因此可以减少能耗、减少CO2的排放等(即节能、低碳);
(4)加热反应的反应物为轻烧产生的氧化镁、研磨时加入的硫酸铵溶液,生成物是氨气,由此推断加热时溶液中发生复分解反应,根据电解质拆分原则、电荷和原子守恒原理,则该反应为MgO+2NH4+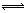 Mg2++2NH3↑+H2O;
Mg2++2NH3↑+H2O;
(5)读图可知,随着温度的升高,反应速率加快,平衡向正反应方向移动,则达到平衡的时间缩短,平衡时铵根离子浓度减小,由此可以确定373K时曲线的起点、平衡点或拐点,从而可以画出曲线。
本题难度:一般
3、选择题 某温度下,反应2A(g)
常温
?B(g)+C(g)的平衡常数为1,在溶积为2L的密闭容器中加入A(g),20s时测得各组分的物质的量如下表( )
| 物质 | A(g) | B(g) | C(g)
物质的量/mo1
1.2
0.6
0.6
下列说法正确的是.
A.反应前20s的平均速率为v(A)=0.6mo1.L-1?S-1
B.20s时,正反应速率等于逆反应速率
C.达平衡时,A(g)的转化率为100%
D.若升高温度,平衡常数将变为0.5,则反应的△H<0
参考答案:依据化学反应的三段式列式计算,
???????????
本题解析:
本题难度:简单
4、填空题 (14分)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)  ?CO2(g)+H2(g)????????? ?CO2(g)+H2(g)?????????
某研究小组分别在体积均为2?L的恒容密闭容器中加入一定量的反应物,使其发生反应,相关数据如下:
容器
编号
| 温度
/℃
| 起始量/mol
| 平衡量/mol
| 达到平衡的时间/min
| 达平衡时体系能量的变化/kJ
| CO
| H2O
| CO2
| H2
| ①
| 650
| 1
| 2
| 0.4
| 0.4
| 5
| 16.4kJ
| ②
| 650
| 2
| 4
| ?
| ?
| t1
| Q1 kJ
| ③
| 900
| 2
| 4
| 1.6
| 1.6
| t2
| Q2 kJ
(1)计算容器②中反应的平衡常数K=?????????(计算结果保留两位小数)。
(2)容器③中反应达平衡时,CO的转化率为????????????。
(3)容器①中反应达平衡这段时间,化学反应速率v (H2) =??????????????。
(4)该反应的正反应为???????(填“吸热”或“放热”)反应,理由是???????????。?
(5)下列叙述正确的是 ?????????????(填字母序号)。
a.平衡时,容器①和容器②中CO2的体积分数相等
b.反应达平衡状态时,Q2 > Q1> 32.8 kJ
c.达到平衡的时间:t2> t1>2.5 min
d.该反应的热化学方程式可表示为:CO(g)+H2O(g)  ?CO2(g)+H2(g)????△H=-41 kJ/mol ?CO2(g)+H2(g)????△H=-41 kJ/mol
(6)容器②中反应进行到t min时,测得混合气体中CO2的物质的量为0.6 mol。若用200 mL 5 mol/L的NaOH溶液将其完全吸收,得到的溶液中所有离子的物质的量浓度由大到小的顺序为????????????????????。
参考答案:(1)0.17(2分)
(2)80℅(2分)?
本题解析:
试题分析:(1)②和①为等效平衡,转化率相等,为40%,所以K=(0.8×0.8)/(1.2×3.2)=0.17。
(2)CO2的量为1.6mol,所以CO也转化了1.6mol,转化率为1.6/2=80%。(3)v (H2) =0.4/(2×5)=0.04mol·L-1?min-1。(4)比较反应②、③,升高温度,反应物的转化率增大,所以为吸热。(5)a.①和②为等效平衡所以体积分数相等,a正确。b.达到平衡后Q2 > Q1="32.8" kJ,b错。c.由于③的温度比②高,所以③的反应速率更快,时间更短,c错。d.△H>0,d错。(6)按照方程式计算,碳酸钠有0.4mol,碳酸氢钠有0.05mol,而碳酸根发生水解,浓度比钠离子低,其次是碳酸氢根,而由于碳酸根水解,碳酸氢根水解,氢氧根离子比氢离子浓度高,即:c(Na+)> c (CO32-)>c(HCO3-)>c(OH-)>c(H+)。
点评:本题将化学反应平衡与盐类水解相结合,考点综合,学生需牢固掌握这两部分知识。
本题难度:一般
5、选择题 将CO2转化成甲醇燃料是减排、环保的一种科学方法,其原理为:CO2(g) +3H2(g) CH3OH(g)+ H2O(g) △H<0。500℃时,在固定容积为1 L的密闭容器中充入1 mol CO2、3 mol H2,测得CO2浓度与甲醇浓度随时间的变化如图所示。从中得出的下列结论中错误的是 CH3OH(g)+ H2O(g) △H<0。500℃时,在固定容积为1 L的密闭容器中充入1 mol CO2、3 mol H2,测得CO2浓度与甲醇浓度随时间的变化如图所示。从中得出的下列结论中错误的是
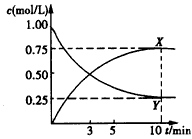 [???? ] [???? ]
A.曲线X表示CH3OH浓度变化,曲线Y表示CO2浓度变化
B.从反应开始到平衡,氢气的反应速率v(H2) =0. 225 mol/(L·min)
C.平衡时H2的转化率为75%
D.该反应的平衡常数K=3
参考答案:D
本题解析:
本题难度:一般
|
|
网站客服QQ: 960335752 - 14613519 - 791315772