微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 平衡:如化学平衡、溶解平衡、电离平衡。下列不存在平衡的是(不考虑水的电离平衡)
A.稀醋酸水溶液中
B.氢氧化钙悬浊液中
C.二氧化硫与氧气反应的混合物中
D.稀氯化钠水溶液中
2、填空题 (14分)T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示,3分钟时达到平衡;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。?
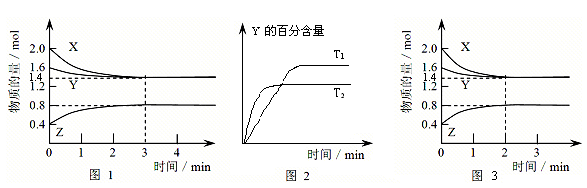
(1)容器中发生的反应可表示为______?________?________?__
(2)该反应的△H?????0(填“>”、“<”或“=”)
判断理由是:______?________?________?________?____?________?__。
(3)反应进行的前3 min内,用X表示的反应速率 v(X)=____________
(4)保持其他条件不变,升高温度,该反应的化学平衡常数K将____________(填“变大”、“减小”或“不变”)
(5)①若改变反应条件,使反应进程如图3所示,则改变的条件是____________
②一定条件下的密闭容器中,该反应达到平衡,要提高气体Y的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压???? b.加入催化剂??? c.增加X的浓度??? d.增加气体Y的浓度???
3、计算题 一定温度下,向密闭容器中加入等物质的量的SO2和O2,反应达平衡时,SO2的转化率是50%,此时SO3所占的体积分数为多少?
4、计算题 “温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组
| 温度/℃
| 起始量/mol
| 平衡量/mol
| 达到平衡所需时间/min
|
CO
| H2O
| H2
| CO
|
1
| 650
| 4
| 2
| 1.6
| 2.4
| 6
|
2
| 900
| 2
| 1
| 0.4
| 1.6
| 3
|
3
| 900
| a
| b
| c
| d
| t
?
① 实验1条件下平衡常数K=?????(保留小数点后二位数字)。
② 实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值????(填具体值或取值范围)。
③ 实验4,若900℃时,在此容器中加入10molCO、5molH2O、2molCO2、5molH2,则此时v(正)?????v(逆)(填“<”、“>”、“=”)。
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L,则生成沉淀所需CaCl2溶液的最小浓度为???。
(3)已知BaSO4(s) + 4C(s) ="4CO(g)" + BaS(s)??△H1 =+571.2kJ/mol,
BaSO4(s) + 2C(s) = 2CO2(g) + BaS(s)??△H2="+226.2" kJ/mol。
则反应C(s) + CO2(g) = 2CO(g)的△H3=??????kJ/mol。
 (4)寻找新能源是解决温室效应的一条重要思路。磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池,总反应为:FePO4+Li ???????LiFePO4,电池中的固体电解质可传导Li+,则该电池放电时的正极和负极反应式分别为:????????????????和?????????????????。若用该电池电解蒸馏水(电解池电极均为惰性电极),当电解池两极共有3360mL气体(标准状况)产生时,该电池消耗锂的质量为???????。(Li的相对原子质量约为7.0) (4)寻找新能源是解决温室效应的一条重要思路。磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池,总反应为:FePO4+Li ???????LiFePO4,电池中的固体电解质可传导Li+,则该电池放电时的正极和负极反应式分别为:????????????????和?????????????????。若用该电池电解蒸馏水(电解池电极均为惰性电极),当电解池两极共有3360mL气体(标准状况)产生时,该电池消耗锂的质量为???????。(Li的相对原子质量约为7.0)
5、选择题 已知常温常压和催化剂条件下,N2(g)和H2(g)生成2 mol NH3(g)放出92.4 kJ的热量。在上述条件下向密闭容器中通入1 mol N2和3 mol H2,达到平衡时放出热量为Q1 kJ;向另一体积相同的容器中通入0.9 mol N2、2.7 mol H2和0.2 mol NH3,相同条件下达到平衡时放出热量为Q2 kJ。则下列关系式正确的是(??? )
A.2Q=Q1="92.4"
B.Q2<Q1<92.4
C.Q1<Q2<92.4
D.Q1=Q2=92.4
|