Z
| 496
| 4 562
| 6 912
| 9 543
则X、Y、Z的电负性从大到小的顺序为 (用元素符号表示),元素Y的第一电离能大于X的第一电离能的原因是 ??????????
????????????????????????????????????????????????????? 。?
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小。D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C三原子都采取sp3杂化。
①A、B、C的第一电离能由小到大的顺序为 (用元素符号表示)。?
②M是含有 键的 分子(填“极性”或“非极性”)。?
③N是一种易液化的气体,请简述其易液化的原因:?????????????????
???????????????????????????????????????????????????? 。?
④W分子的VSEPR模型的空间构型为 ,W分子的空间构型为 。?
⑤AB-中和B2分子的π键数目比为 。?
(3)E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4s1。
①E元素组成的单质的晶体堆积模型为 (填字母)。?
a.简单立方堆积? b.体心立方堆积
c.六方最密堆积? d.面心立方最密堆积
②F元素在其化合物中最高化合价为 。?
③G2+的核外电子排布式为 ????????????????????????????????,G2+和N分子形成的配离子的结构式为 。
参考答案:(1)Al>Mg>Na 元素Mg价电子排布式为3
本题解析:(1)X、Y、Z为第三周期元素,根据其原子的第一至第四电离能知,X、Y、Z分别为Al、Mg、Na,X、Y、Z的电负性从大到小的顺序为Al>Mg>Na,元素Mg价电子排布式为3s2,处于全充满状态,比Al价电子排布稳定,则Mg的第一电离能大于Al的第一电离能。(2)根据题给信息知,A、B、C、D分别为碳、氮、氧、氢。①由于N元素的p电子满足洪特规则特例,能量降低,第一电离能升高,故N元素的第一电离能比氧元素的第一电离能大,则C、N、O的第一电离能由小到大的顺序为:C<O<N;②M为甲
本题难度:一般
2、填空题 金属键是在________起作用的,而且金属键一般__________,所以金属键断裂比较困难,而且决定金属具有____、_______和____。
参考答案:整个晶胞的范围内;较强;延性;展性;可塑性
本题解析:
本题难度:一般
3、填空题 元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p 轨道上有4个电子。元素Z 的原子最外层电子数是其内层的3倍。
(1)X与Y所形成化合物晶体的晶胞如图所示。
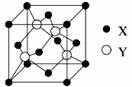
①在1个晶胞中,X离子的数目为?????。
②该化合物的化学式为?????????。若其晶胞边长为540.0pm,则密度为???????????????????????,X与最近的Y之间的距离为?????????????????
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是???????。
(3)Y 与Z 可形成YZ42-
①YZ42-的空间构型为??????????(用文字描述)。
②写出一种与YZ42-互为等电子体的分子的化学式:?????????。
(4)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为???。
参考答案:(1)①4?②ZnS?;4.1g/cm3;
本题解析:
试题分析:元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2,所以X是Zn。元素Y基态原子的3p 轨道上有4个电子,则Y应该是S元素。元素Z 的原子最外层电子数是其内层的3倍,则Z是氧元素。
(1)①根据晶胞结构冰依据均摊法可知,在1个晶胞中,X离子的数目为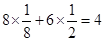 个。 个。
②同
本题难度:困难
4、选择题 根据化学反应的实质是旧键断裂新键形成这一事实,下列变化不属于化学变化的是 [???? ]
A.白磷在260℃时转化为红磷
B.HCl气体溶于水
C.NaCl熔化
D.P2O5吸水
参考答案:BC
本题解析:
本题难度:简单
5、选择题 下列叙述正确的是( )
A.所有分子中都存在共价键
B.F2、C12、Br2、I2的熔沸点逐渐升高与分子间作用力大小有关
C.第VIA族元素的气态氢化物H2O、H2S、H2Se的熔沸点依次升高
D.只要是离子化合物,其中就一定还有金属元素
参考答案:B
本题解析:
本题难度:一般
|