微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (15分)电石的主要成分为CaC2,易与水反应生成C2H2,故C2H2俗称电石气。某同学设计如下方案测定电石中CaC2的纯度(杂质不参加反应)。
实验原理:CaC2+2H2O=Ca(OH)2+C2H2↑
通过测定生成的气体的体积(标准状况),可确定样品中CaC2的含量。
实验步骤:
①取样品1.2g;
②把1.2 g样品放入气密性良好的气体发生装置,如图所示;
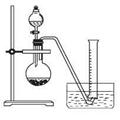
③向样品中滴入水,至不再产生气泡,用量筒排水集气,量筒内液面在360mL处恰与水槽内液面相平
④作为反应器的烧瓶中有24 mL液体。
请回答下列问题:
(1)上述实验所用的玻璃仪器有导管、水槽、 、 、 。
(2)若实验前有1000 mL、500 mL、250 mL的量筒备用,则应选用 mL的量筒。
(3)生成气体体积是 mL,为保证生成气体体积的准确性,读取量筒刻度时应注意的问题是 。
(4)若将C2H2通入KMnO4溶液中,KMnO4溶液的紫红色会变浅,配平并完成化学方程式
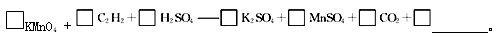
若该实验生成的C2H2完全被KMnO4溶液氧化,至少需0.1 mol ? L-1的KMnO4溶液 mL。
(5)通过以上数据计算,可得样品中CaC2的纯度为 。
参考答案:(1)圆底烧瓶、分液漏斗、量筒(3分)
本题解析:
试题分析:(1)根据装置图可知上述实验所用的玻璃仪器有导管、水槽、圆底烧瓶、分液漏斗、量筒。
(2)1.2g碳化钙最多生成标准状况下乙炔的体积是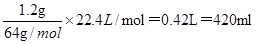 ,因此应选用500mL的量筒。
,因此应选用500mL的量筒。
(3)向样品中滴入水,至不再产生气泡,用量筒排水集气,量筒内液面在360mL处恰与水槽内液面相平。但由于作为反应器的烧瓶中有24 mL液体,则生成气体体积是360ml—24ml=336ml。由于气体的体积受温度和压强影响较大,所以为保证生成气体体积的准确性,读取量筒刻度时应注意的问题是使量筒内外液面相平、视线与量筒内液面的最低处相切。
(4)乙炔中碳元素的化合价是—1价,反应后变为+4价,失去5个电子。高锰酸钾中锰元素的化合价从+7价降低到+2价,得到5个电子,则根据电子得失守恒和原子守恒可知配平后的方程式为2KMnO4+C2H2+3H2SO4=K2SO4+2MnSO4+2CO2+4H2O。乙炔的物质的量是0.336L÷22.4L/mol=0.015mol,则根据方程式可知需要高锰酸钾是0.03mol,所以至少需0.1 mol ? L-1的KMnO4溶液的体积是0.03mol÷0.1mol/L=0.3L=300mL。
(5)根据碳原子守恒可知样品中CaC2的物质的量是0.015mol,则纯度为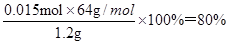 。
。
考点:考查电石含量测定实验方案设计与探究
本题难度:困难
2、填空题 随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金维生素”。已知钒的原子序数为23,回答下列问题:
(1)钒被认为是一种稀土元素,广泛分散于各种矿物中。钾钒铀矿中的钒原子最外层已达8电子稳定结构,其化学式为K2H6U2V2O15,若用氧化物的形式表示,该化合物的化学式为_______________________。
(2)测定钒含量的方法是先把钒转化成V2O5,V2O5在酸性溶液里转变成VO2+,再用盐酸、硫酸亚铁、草酸等测定钒。总反应式可表示为:
VO2++H2C2O4→VO++CO2+H2O(未配平)
其中还原剂是_______。若消耗0.9 g草酸,所对应钒元素质量是_______g。
参考答案:⑴K2O·2UO3·V2O5·3H2O。?⑵H2C2O4??
本题解析:(1)要用氧化物形式表示该化合物的化学式,必须先确定钒、铀的化合价。由于钾元素必定显+1价,根据“钒原子最外层已达8电子稳定结构”,可推出钒应失去5个电子变成氩原子结构,所以钒元素显+5价。再根据化合价规律可计算出铀的化合价应是+6。
(2)将题给反应式配平可得:VO2++H2C2O4= VO++2CO2↑+H2O。根据配平后的方程式计算可得到钒元素的质量数值。
本题难度:一般
3、选择题 氧化还原反应实际上包含氧化和还原两个过程。
(1)向氯酸钠的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为:
SO2+2H2O - 2e- → SO42- + 4H+;
(2)向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,该反应中还原过程的反应式为:
Cl2 + 2e- → 2Cl-。
在(1)和(2)反应中均会生成产物X,则X的化学式为 [???? ]
A.NaClO
B.HClO
C.ClO2
D.NaClO4
参考答案:C
本题解析:
本题难度:简单
4、选择题 下列物质中,属于新型无机非金属材料的是
A.钢化玻璃
B.碳化硼玻璃
C.光导纤维
D.硼酸盐玻璃
参考答案:B、C
本题解析:新型无机高分子材料的品种较多:如高温结构陶瓷和光导纤维等,其中如氧化铝陶瓷、氮化硅陶瓷、碳化硼陶瓷等属于高温结构陶瓷。
本题难度:简单
5、选择题 一定条件下用甲烷可以消除氮氧化物(NOx)的污染。已知:
① CH4 ( g )+4NO2( g )=4NO( g ) +CO2( g )+2H2O( g )???△H=一574 kJ·mol-1?
② CH4 ( g )+4NO( g )=2N2( g )+CO2( g )+2H2O( g )?????△H=一1 160 kJ·mol一1。
下列正确的选项是
A.CH4 ( g )+2NO2 ( g )= N2( g )+CO2 ( g )+2H2O ( l)△H=一867 kJ·mol-1
B.CH4催化还原NOx为N2的过程中,若x=1.6,则转移的电子总数为3.2 mol
C.若0.2 mol CH4还原NO2至N2,在上述条件下放出的热量为173.4 kJ
D.若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移的电子总数为3.2 mol
参考答案:C
本题解析:① CH4 ( g )+4NO2( g )=4NO( g ) +CO2( g )+2H2O( g )?△H=一574 kJ·mol-1?
② CH4 ( g )+4NO( g )=2N2( g )+CO2( g )+2H2O( g )?????????△H=一1 160 kJ·mol一1。
( ①+②)/2, 得CH4 (
本题难度:一般