微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知M2O7x-+3S2-+14H+=2M3++3S↓+7H2O,则M2O7x-中M的化合价为
A.+2
B.+3
C.+4
D.+6
参考答案:D
本题解析:略
本题难度:一般
2、选择题 将0.195g锌粉加入到20.0mL的0.100 mol·L-1MO2+溶液中,恰好完全反应,则还原产物可能是(??)
A.M
B.M2+
C.M3+
D.MO2+
参考答案:B
本题解析:
试题分析:n(Zn)= 0.195g ÷65g/mol=0.003mol,Zn是+2价的金属,假设反应后M的化合价为+x价,根据氧化还原反应中电子转移数目相等可知:0.003×2=0.1×0.02(5-x),解得x=+2价,对选项中含M的微粒的化合价进行分析可知:还原产物是M2+,所以选项是B。
本题难度:一般
3、选择题 含铬Cr2O72-废水用硫亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀干燥后得到nmolFeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是
A.消耗硫酸亚铁铵的物质量为n(3x+1)mol
B.处理废水中Cr2O72-的物质量为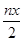 mol
mol
C.反应中发生转移的电子数为1.5nxmol
D.在FeO·FeyCrxO3中3x=y
参考答案:C
本题解析:A.由铁元素守恒,消耗硫酸亚铁铵的物质的量为n(y+1),又由FeO?FeyCrxO3电中性知3x+3y=6,代入前式得,消耗硫酸亚铁铵的物质的量为n(3-x);或由得失电子守恒得3x=y,代入得n×(1+y)mol=n×(3x+1)mol,A正确;B.根据铬原子守恒,Cr原子为nxmol,故Cr2O72-的物质的量为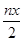 本题难度:一般
本题难度:一般
4、选择题 下列各组比较项目包含的数据关系中,前者比后者大的是(???)
A.氯水与氨水中微粒种数
B.H2O2与O2分子中氧氧键键能
C.CH4分子与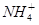 离子中的键角
离子中的键角
D.相同质量的铜片分别和过量浓硝酸、稀硝酸反应转移的电子数
参考答案:A
本题解析:
试题分析:A选项氯水中微粒种类有7种,氨水中微粒种类有6种,正确。B选H2O2中时氧氧单键,而O2是氧氧双键,双键键能大,错误。C选项CH4分子与NH4+都是正四面体,键角一样大,错误。D选项因Cu片的质量相同,转移的电子数相同,错误。
本题难度:一般
5、填空题 (8分)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。
已知该反应中H2O2只发生如下过程:H2O2 → O2
(1)写出该反应的化学方程式,并标出电子转移的方向和数目。
??????????????????????????????????????????????????????????????????????
(2)该反应中的氧化剂是???????????。
(3)若反应转移了0.3 mol电子,则产生的气体在标准状况下体积为??????????????。
参考答案:(1) 本题解析:H2O2→O2,说明双氧水是还原剂,氧元素的化合价从-1价升高到0价,失去2个电子H2CrO4是氧化剂,氢氧化铬是还原产物,Cr化合价从+6价降低到+3价,得到3个电子,因此根据电子的得失守恒可知,还原剂和氧化剂的物质的量之比是3︰2,所以方程式为
本题解析:H2O2→O2,说明双氧水是还原剂,氧元素的化合价从-1价升高到0价,失去2个电子H2CrO4是氧化剂,氢氧化铬是还原产物,Cr化合价从+6价降低到+3价,得到3个电子,因此根据电子的得失守恒可知,还原剂和氧化剂的物质的量之比是3︰2,所以方程式为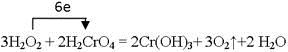 。根据方程式可知,若反应转移了0.3 mol电子,则生成氧气是0
。根据方程式可知,若反应转移了0.3 mol电子,则生成氧气是0
本题难度:一般