微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 Na2SO3和NaClO两种钠盐分别溶于水后,溶液的pH均大于7,露置于空气中相当一段时间后(不考虑水分挥发)溶液pH都近似为7。这两种溶液呈碱性的原因分别是:_______________________、________________________(用离子方程式表示)。久置呈中性的原因是_____________________________________________________________________。
2、选择题 常温下,向20 mL 0.1 mol·L-1CH3COOH溶液中逐滴加入0.1 mol·L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是( )。
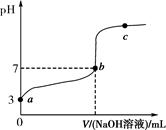
A.a与b之间的溶液中只存在:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.b与c之间的溶液中不存在:c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
C.b点时,V(NaOH溶液)=20 mL,且c(CH3COO-)=c(Na+)
D.a、b、c点表示的溶液中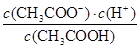 均相等
均相等
3、选择题 1943年,侯德榜先生研究成功了联合制碱法,该方法不仅提高了食盐的利用率,还在得到纯碱的同时获得了重要的副产品氯化铵。下列关于Na2CO3溶液和NH4Cl溶液的说法正确的是
A.适当升温,两溶液的pH均增大
B.常温下pH=10的碳酸钠溶液与pH=4的氯化铵溶液中水的电离程度相同
C.0.1 mol/L Na2CO3溶液中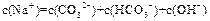
D.0.1 mol/L NH4Cl溶液中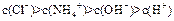
4、选择题 常温下,向等物质的量浓度的两种一元酸的盐溶液中,分别通入少量的CO2,发生如下反应:NaA+CO2+H2O===HA+NaHCO3 2NaB+CO2+H2O===2HB+Na2CO3,则等物质的量浓度的HA和HB在水中电离出H+的能力大小关系是??? ( )
A.HA较强
B.HB较强
C.两者一样
D.无法比较
5、填空题 ⑴下列物质属于非电解质的是?????????,属于弱电解质的是???????(填序号)。
①氨水? ②SO2? ③CI2? ④次氯酸? ⑤BaSO4???⑥乙醇? ⑦H2O? ⑧NaHCO3
⑵用浓度为0.1 mol·L-1标准盐酸滴定氢氧化钠溶液时,以下操作会使结果偏低的是
????????????????????????????(填序号)。
①锥形瓶用待测液润洗???????????????? ②酸式滴定管读数是滴前仰视滴后俯视?
③配制氢氧化钠溶液时混有碳酸钠?????? ④酸式滴定管未用标准液润洗
(3) 向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全,写出反应的离子方程式:?????????????????????????????;此时溶液呈?????性(填“酸性”,“中性”或“碱性”),原因:??????????????????????????????????。