微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 (12分)如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
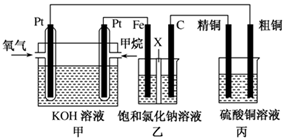
(1)甲烷燃料电池负极反应式是?????????????????????????????;
(2)石墨(C)极的电极反应式为???????????????????????????????;
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁极上生成?的气体体积为________L ,丙装置中阴极析出铜的质量为________g ;
(4)某同学利用甲烷燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图所示)。

若用于制漂白液,a为电池的________极,电解质溶液最好用________;若用于制Fe(OH)2,使用硫酸钠作电解质溶液,阳极选用________作电极。
参考答案:(12分) (1)? CH4 +10OH- -8e-=CO3
本题解析:
试题分析:燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极。
(1)燃料电池中,负极上投放燃料,所以投放甲烷的电极是负极,负极上失电子发生氧化反应,电极反应式为:CH4+10OH--8e-=CO32-+7H2O;
(2)甲中投放氧化剂的电极是正极,所以乙装置中石墨电极是阳极,阳极上氯离子失电子发生氧化反应,电极反应式为:2Cl--2e-=Cl2↑;
(3)串联电池中转移电子数相等,若在标准状况下,有2.24L氧气参加反应,氧气的物质的量是2.24L÷22.4L/mol÷0
本题难度:一般
2、实验题 (17分)如右图所示:
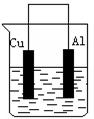
(1)将铜棒和铝棒用导线连接后置于盛稀盐酸的烧杯中,看到的现象是 。铝棒做 极,该极的电极反应方程式为 _______ 。
(2)如果将盐酸换成NaOH溶液,该电池发生的总反应离子方程式为_________________。
此时铝棒做 极,该极的电极反应方程式为 。
(3)如果将盐酸换成浓硝酸溶液,则铝棒做 极。
参考答案:
 本题解析:略
本题解析:略
本题难度:一般
3、选择题 把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为[???? ]
A.a > b > c > d
B.a > c > d > b
C.c > a > b > d
D.b > d > c > a
参考答案:B
本题解析:
本题难度:一般
4、选择题 甲醇-空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,其工作原理如下图。下列有关叙述正确的是
A.H +从正极区通过交换膜移向负极区
B.负极的电极反应式为:CH3OH(l) + H2O(l)-6e-=CO2(g) + 6H +
C.d导出的是CO2
D.图中b、c分别是O2、甲醇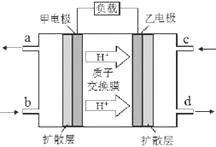
参考答案:B
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。所以甲醇在负极通入,空气在正极通入。所以选项B是正确的,答案选B。
本题难度:一般
5、填空题 I.1100℃时,在恒容密闭容器中,发生如下可逆反应: Na2SO4(s)+4H2(g) Na2S(s)+4H2O(g),并达到平衡。请完成下列各题:
Na2S(s)+4H2O(g),并达到平衡。请完成下列各题:
(1)达到平衡时的平衡常数表达式:K=________;降低温度,K值减小,则正反应为_________(填“吸热”或“放热”)反应。
(2)向该容器中分别加入以下物质,对平衡的影响如何?
①加入少量Na2SO4,则平衡____________(填所选字母,下同);
②加入少量灼热的Fe3O4,则平衡_____________。
a.正向移动??b.逆向移动??c.不发生移动
Ⅱ.将CH4设计成燃料电池,其利用率更高,装置示意如图 (A、B为多孔性碳棒),持续通入甲烷,在标准状况下,消耗甲烷体积VL。????
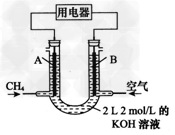
(1)0<V≤44.8?L时,电池总反应方程式为_____________; ??
(2)44.8?L<V≤89.6?L时,负极的电极反应式为__________; ??
(3)V?=67.2?L时,溶液中阴离子浓度大小关系为________________
参考答案:Ⅰ.?(1)c4?(H2O)/c4?(H2)??;吸热 ;a
本题解析:
本题难度:一般