微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (18分)甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
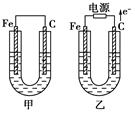
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒。
②乙池中阳极的电极反应式是_______________________________________________ _
(2)若两池中均为饱和NaCl溶液:
①乙池中碳极上电极反应属于____________(填“氧化反应”或“还原反应”),写出乙池中该电极反应的离子方程式_______________________________________。
②甲池中碳极上电极反应式是_____________,检验该负极反应产物的方法是_____________________________用离子方程式表示_______________________________
③若乙池转移0.02 mol e-后停止实验,池中溶液体积是200 mL,则溶液混匀后的pH=________。
参考答案:
(1)①碳 铁
②4OH--4e-===2H2
本题解析:
(1)①碳(正极) 铁(阴极)
②阳极为碳棒,失电子,4OH--4e-===2H2O+O2↑
(2)① 氧化反应 2Cl--2e-=Cl2↑-
②2H2O+O2+4e- =4OH- 滴加2滴铁氰化钾溶液,看到有蓝色沉淀出现,说明生成了Fe2+ 3Fe2+ +2[Fe(CN)6]3-
=4OH- 滴加2滴铁氰化钾溶液,看到有蓝色沉淀出现,说明生成了Fe2+ 3Fe2+ +2[Fe(CN)6]3-  = Fe3[Fe(CN)6]2(蓝色),生成物叫普鲁士蓝
= Fe3[Fe(CN)6]2(蓝色),生成物叫普鲁士蓝
③H+ 浓度为:0.02mol/0.200L=0.1mol/L,pH= 13
本题难度:简单
2、选择题 下列有关电化学的示意图正确的是( )
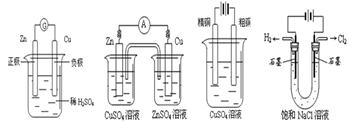
A B C (电解精炼铜) D
参考答案:D
本题解析:
试题分析:A中Zn为负极,Cu为正极。B中两个半电池应该是Zn—ZnSO4、Cu—CuSO4。C中电解精炼铜粗铜为阳极,精铜为阴极。
考点:电化学知识
点评:考查电化学的示意图,难度一般,解题的技术是要认清原电池和电解池,正负极材料的选择。
本题难度:简单
3、选择题 在用Zn片、Cu片和稀硫酸组成的原电池装置中,经过一段时间工作后,下列说法正确的是[???? ]
A.锌片是正极,铜片上有气泡产生
B.电流方向是从锌片流向铜片?
C.溶液中硫酸的物质的量浓度减小
D.电解质溶液的pH保持不变
参考答案:C
本题解析:
本题难度:一般
4、选择题 下列叙述是某同学做完铜锌原电池实验后得出的结论和认识,正确的是( )
A.构成原电池正极和负极的材料必须是两种金属
B.由铜锌作为电极与硫酸铜溶液组成的原电池中,铜是负极
C.电流通过硫酸溶液,SO42- 向正极移动
D.铜锌原电池工作时,若有13 g锌被溶解,电路中就有0.4 mol 电子通过
参考答案:D
本题解析:
试题分析:A、构成原电池正负极的材料不一定都是金属,如锌、石墨和稀硫酸也能构成原电池,故A错误;B、原电池中,易失电子的金属作负极,所以由铜锌作为电极与硫酸铜溶液组成的原电池中,Zn是负极,故B错误;C、原电池放电时,阴离子向负极移动,所以硫酸根离子向负极移动,故C错误;D、负极电极反应为Zn-2e-=Zn2+,根据锌和转移电子关系得转移电子的物质的量=(13g÷65g/mol)×2=0.4mol,故D正确;故选D。
考点:考查原电池原理
本题难度:一般
5、选择题 从理论上分析,关于Fe—CuSO4溶液—Cu原电池的叙述正确的是
A.铜极为负极
B.电子从铜沿导线转移到铁
C.铁表面析出金属铜
D.总反应为Fe + CuSO4 = FeSO4 + Cu
参考答案:D
本题解析:略
本题难度:简单