微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法错误的是
①NaHCO3溶液加水稀释,c(Na+)/c(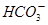 )的值保持增大
)的值保持增大
②浓度均为0.1mol·L-1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c( )+c(
)+c(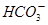 )]
)]
③在0.1mol·L-1氨水中滴加0.1mol·L-1盐酸,恰好完全反应时溶液的pH=a,则由水电离产生的c(OH-)=10-a mol·L-1
④向0.1mol·L-1(NH4)2SO3溶液中加入少量NaOH固体,c(Na+)、c(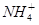 )、c(
)、c(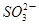 )均增大
)均增大
⑤在Na2S稀溶液中,c(H+)=c(OH-)+2c(H2S)+c(HS-)
A.①④
B.②④
C.①③
D.②⑤
参考答案:B
本题解析:
试题分析:①加水稀释,碳酸氢根的水解程度增大,所以比值增大,正确;②在同业中遵循物料守恒,钠原子:碳原子=3:2,所以有2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)],错误;③恰好完全反应时,溶液中的氢离子和氢氧根离子都是水电离的,所以溶液的pH=a,则溶液中的氢离子浓度=10-amol/L,则氢氧根离子浓度也为10-amol/L,正确;④加入氢氧化钠固体,促进铵根离子水解,抑制亚硫酸根离子水解,所以铵根离子浓度减小,亚硫酸根离子浓度增大,错误;⑤根据溶液中质子守恒,即水电离的氢离子和氢氧根离子浓度永远相等,可以写出c(H+)=c(OH-)+2c(H2S)+c(HS-),正确;所以选B。
考点:溶液的酸碱性和溶液中的离子浓度比较
本题难度:困难
2、选择题 把下列溶液加水稀释,溶液中每种离子的浓度都不会增加的是
A.CH3COOH溶液
B.NaCl溶液
C.NaOH溶液
D.FeCl3溶液
参考答案:B
本题解析:稀释过程中溶液中每种离子的浓度都不会增加说明不会水解(无弱离子)也不是酸和碱,是强酸强碱盐.
本题难度:困难
3、填空题 已知甲、乙、丙分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
Ⅰ.若甲的化学式为RCl3,其溶液在加热蒸干并灼烧时可发生反应:
a.甲+H2O 乙+丙 b.乙
乙+丙 b.乙 氧化物+H2O
氧化物+H2O
①若甲为某用途广泛的金属元素的氯化物,其溶液在上述变化中生成的氧化物为红棕色粉末,则甲发生a反应的化学方程式为:
②若甲为某短周期金属元素的氯化物,则该金属在周期表中的位置是: ;
若向30 mL 1 mol/L的甲的溶液中逐渐加入浓度为4 mol/L的NaOH溶液,若产生0.78 g白色沉淀,则加入的NaOH溶液的体积可能为 (选填编号).
A.3 mL
B.7.5 mL
C.15 mL
D.27.5 mL
③将以上两种金属单质用导线连接,插入一个盛有NaOH溶液的烧杯中构成原电池,则负极发生的电极反应为 。
Ⅱ.若甲,乙、丙均是短周期中同一周期元素形成的单质或化合物,常温下乙为固体单质,甲和丙均为气态化合物,且可发生反应:甲+乙 丙。则:
丙。则:
①写出上述反应的化学方程式 。
②0.5 mol气体甲与足量的过氧化钠反应,转移电子的数目为
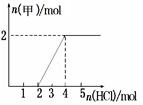
③将一定量气体甲通入某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(甲)的关系如图所示,溶液A中各离子浓度由大到小的顺序为 。
参考答案:Ⅰ.①FeCl3+3H2O 本题解析:
本题解析:
试题分析:Ⅰ.①甲为三价金属氯化物,常见的只有铝和铁,又因为生成的氯化物为红棕色粉末,所以甲一定为FeCl3,则甲发生a反应的化学方程式为:FeCl3+3H2O Fe(OH)3↓+3HCl↑
Fe(OH)3↓+3HCl↑
②若甲为某短周期金属元素的氯化物,则该金属为Al,在元素周期表中位于:第三周期,第ⅢA族;30 mL 1 mol/L的甲的溶液含AlCl30.03mol,逐渐加入浓度为4 mol/L的NaOH溶液,产生0.78 g白色沉淀,为0.01mol的Al(OH)3,可能为AlCl3与NaOH直接反应生成0.01molAl(OH)3,Al3++3OH?=Al(OH)3↓加入的NaOH溶液的体积为:0.01mol×3÷4mol?L?1=0.0075L=7.5mL,也可能为AlCl3与NaOH全部反应转化为Al(OH)3,继续滴加NaOH溶液,溶解部分Al(OH)3,剩余的Al(OH)3为0.01mol,Al3++3OH?=Al(OH)3↓需要NaOH为3n(Al3+)=0.03mol×3=0.09mol,Al(OH)3+OH? ==AlO2-+2H2O,需要NaOH为0.03mol-0.01mol=0.02mol,共需要NaOH溶液:(0.09mol+0.02mol)÷4mol?L?1=0.0275L=27.5mL,故BD项。
③由于在碱性溶液中,只有铝能失电子发生反应,所以Al为负极,失去电子转化为AlO2-,所以负极反应式为:Al-3e-+4OH-=AlO2-+2H2O。
Ⅱ.①甲、乙、丙为短周期元素,乙为固体单质,甲丙为气体,甲、乙高温下生成丙,且三者均位于同一周期,只可能为C、N、O三元素组成的化合物,综合分析可知:甲为CO2,乙为碳,丙为CO,所以该反应的化学方程式为:CO2+C 2CO。
2CO。
②气体甲与足量的过氧化钠反应为:2CO2+2Na2O2=2Na2CO3+O2,根据化合价的变化可得:CO2 ~ e?,所以0.5 mol气体甲与足量的过氧化钠反应,转移电子的数目为0.5NA或3.01×1023。
③根据n(HCl)与生成n(甲)的关系图,两段需要的HCl相等,说明溶液A的溶质为Na2CO3,故各离子浓度由大到小的顺序为:c (Na+) > c(CO32-) > c(OH-) >c(HCO3-)>c(H+)
考点:本题考查元素化合物的推断、方程式的书写、根据化学方程式的计算、原电池原理、电子转移、离子浓度比较。
本题难度:困难
4、选择题 部分弱酸的电离平衡常数如下表:
弱酸
| HCOOH
| HCN
| H2CO3
|
电离平衡常数(25℃)
| Ki=1.77×10-4
| Ki=4.9×10-10
| Ki1=4.3×10-7
Ki2=5.6×10-11
下列选项错误的是( )
①2CN-+H2O+CO2=2HCN+CO32-
②2HCOOH+CO32-=2HCOO-+H2O+CO2↑
③中和等体积、等pH的HCOOH和HCN,消耗NaOH的量前者小于后者
④等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
A.①② B.②③ C.③④ D.①④
参考答案:D
本题解析:根据电离常数可知酸性HCOOH>H2CO3>HCN>HCO3-,A错误,B正确;等体积、等pH的HCOOH和HCN溶液所含溶质HCN溶液更多,则中和时消耗的NaOH的量多,C正确;根据电荷守恒,n(HCOO-)+n(OH-)=n(Na+)+n(H+),n(CN-)+n(OH-)=n(Na+)+n(H+),即离子总数是n(Na+)+n(H+)的2倍,而NaCN的水解程度大,即NaCN溶液中的n(OH-)大,n(H+)小,D错误。
本题难度:一般
5、选择题 在一定条件下发生下列反应,其中属于盐类水解反应的是( ? ) A.NH4++2H2O?NH3?H2O+H3O+
B.HCO3-+H2O?H3O++CO32-
C.HS-+H+═H2S
D.Cl2+H2O?H++Cl-+HClO
参考答案:A
本题解析:
本题难度:简单
|