微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 人造地球卫星用到的一种高能电池——银锌蓄电池,它在放电时的电极反应为:Zn + 2OH
参考答案:
本题解析:
本题难度:一般
2、填空题 铅蓄电池是生活中常用的可充电电池,其充电过程与放电过程是完全相反的两个过程。电池总反应为:
? ,请回答下列问题:
,请回答下列问题:
(1)放电时,给出电子的一极发生______反应,其电极反应式为_______。该极充电时将发生_______反应,充电时_______能转化为_____ 能。
(2)放电时,电解质溶液的密度______(填“增大”、“减小”或“不变”)。
(3)放电时,若有0.4 mol H+被消耗,则外电路转移电子的物质的量为_______。
参考答案:(1)氧化;Pb-2e-+SO42- = PbSO4;还原;
本题解析:
本题难度:一般
3、选择题 下列有关以KOH溶液为电解液的氢氧燃料电池的叙述不正确的是
A.正极反应式为:O2 + 2H2O +4e- =4OH-
B.工作一段时间后,电解液中KOH的物质的量浓度不变
C.该燃料电池的总反应式为:2H2+O2=2H2O
D.用该电池电解CuCl2溶液,产生2.24LCl2(标准状况)时,有0.2mol电子转移
参考答案:B
本题解析:
试题分析:A、原电池中负极失去电子,正极得到电子,则氧气在正极通入,电极反应式为O2 + 2H2O +4e- =4OH-,A正确;B、工作一段时间后,溶剂水增加,因此电解液中KOH的物质的量浓度减小,B错误;C、该燃料电池的总反应式为:2H2+O2=2H2O,C正确;D.用该电池电解CuCl2溶液,产生2.24LCl2(标准状况)即0.1mol氯气时,根据阳极电极反应式2Cl--2e-=Cl2↑可知有0.2mol电子转移,D正确,答案选B。
考点:考查电化学原理的应用
本题难度:一般
4、填空题 (19分)运用化学反应原理研究碳、氮、硫等单质及其化合物的反应有重要意义;
(1)甲醇是重要的可再生燃料。已知在常温常压下:
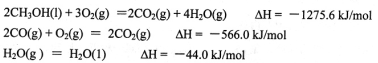
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_________。
(2)利用催化氧化反应将转化为是工业上生产硫酸的关键步骤.
①一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生上述反应,能说明该反应已达到平衡状态的是________。
a.体系的密度不发生变化
b.体系中硫元素的质量百分含量不再变化
c.SO2与SO3的体积比保持不变
d.容器内的气体分子总数不再变化
e.单位时问内转移4 mol电子,同时消耗2molSO3
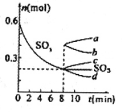
②T℃时,在1L密闭容器中充入0.6 molSO3,下图表示SO3物质的量随时间的变化曲线。达到平衡时,用SO2表示的化学反应速率为________;SO3的转化率为________(保留小数点后-位):T℃时,反应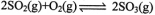 的平衡常数为_______;T℃其他条件不变,在8min时压缩容器体积至0.5 L,则n(SO3)的变化曲线为________(填字母)。
的平衡常数为_______;T℃其他条件不变,在8min时压缩容器体积至0.5 L,则n(SO3)的变化曲线为________(填字母)。
(3)有人设想以N2和H2为反应物,以溶有A物质的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。
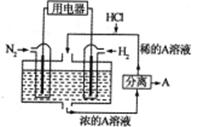
电池正极的电极反应式是_____电解质溶液的pH______(填写增大、减小、不变),A.物质是______(写化学式)。
参考答案:(1)CH3OH(l)+O2(g)=CO(g)+2H2O(l
本题解析:
试题分析:(1)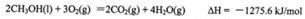 ①
①
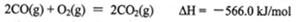 ②
②
 ③
③
ΔH=(①-②+4③)/2=(-1275.6+566.0-4×44.0)/2=-442.8kJ/mol
故热化学方程式为CH3OH(l)+O2(g)=CO(g)+2H2O(l)ΔH=-442.8kJ/mol
(2)①证明反应达到平衡状态的标志是各组分物质的量、物质的量浓度、体积分数、分子总数等不随时间的变化而变化,故选择cd。
②由图可知,当t=8min时反应达到平衡,那么v(SO3)=v(SO2)= =
=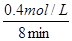 =0.05mol/(L?min)
=0.05mol/(L?min)
ω=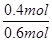 =
= =66.7%
=66.7%
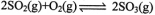
始000.6
转0.40.20.4
平0.40.20.2K= =1.25L/mol
=1.25L/mol
在8min时,压缩容器体积至0.5L,相当于增大压强,平衡向体积缩小的方向移动,即平衡向着生成SO3的方向移动,所以选择曲线c。
(3)以N2和H2为反应物,以溶有A物质的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,由图可知H2为负极,N2为正极,正极的电子,电极反应为N2+8H++6e-=2NH4+;由于H+被消耗,pH值增大;正极产生NH4+,与电解质溶液中的Cl-相结合,形成NH4Cl。
考点:热化学方程式的书写,化学反应速率与化学平衡,原电池的相关知识
本题难度:困难
5、选择题 Al-AgO 电池性能优越,可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O,则下列说法正确的是

A.AgO/Ag电极是负极
B.当电极上析出1.08 g Ag时,电路中转移的电子为0.02mol
C.Al电极的反应式为:Al—3e-+4OH-= AlO2-+2H2O
D.在电解质溶液中OH-由Al电极移向AgO/Ag电极
参考答案:BC
本题解析:
试题分析:电池总反应中铝元素由0升为+3价,发生氧化反应,说明Al电极是负极,而银元素由+1降为0价,发生还原反应,说明AgO/Ag电极是正极,故A错误;由于n=m/M,则正极上析出的Ag为0.01mol,由于2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O~6e一中各物质的系数之比等于物质的量之比,则电路中转移电子的物质的量为Ag的两倍,即0.02mol,故B正确;由总反应推断,负极主要反应物→产物是Al→AlO2一;由于化合价升高总数等于失去电子数,则Al—3e一→AlO2一;由于
本题难度:简单