微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 对于反应A(g)+2B(g) 2C(g),在压强相同的条件下,若生成物C的含量w(C)与时间t的关系如图所示。则下列结论正确的是(?)
2C(g),在压强相同的条件下,若生成物C的含量w(C)与时间t的关系如图所示。则下列结论正确的是(?)
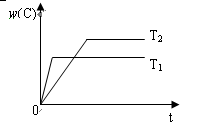
A.T1>T2,正反应放热???????????????????????????????
B.T1<T2 ,正反应放热
C.T1>T2 ,正反应吸热
D.T1<T2 ,正反应吸热
参考答案:A
本题解析:解题思路为:在坐标图中,遵循“先拐先平,数值大”达平衡所需时间更短的原则;即可得T1>T2,再由温度越高w(C)的含量越低可知,该反应的正反应方向为放热反应,所以正确选项为A。
本题难度:简单
2、选择题 以NA代表阿伏加德罗常数,则关于热化学方程式C2H2(g)+
5
2
O2(g)═2CO2(g)+H2O(l)△H=-1300kJ?mol-1的说法中,正确的是( )
A.10NA个电子转移时,该反应放出1300kJ的能量
B.NA个水分子生成且为液体时,吸收1300kJ的能量
C.有2NA个碳氧共用电子对生成时,放出1300kJ的能量
D.有10NA个碳氧共用电子对生成时,放出1300kJ的能量
参考答案:A.10NA个电子的物质的量为10mol,反应中碳元素的化合
本题解析:
本题难度:一般
3、选择题 下列关于反应能量的说法正确的是
A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s)△H=" -216" KJ/mol,反应物总能量小于生成物总能量
B.相同条件下,如果1mol氢原子所具有的能量为E1,1mol氢分子所具有的能量为E2,则2E2=E1
C.101KPa时,2H2(g)+O2(g) =2H2O(l) △H=" -517.6" KJ/mol,若生成气态水,△H小于-517.6 KJ/mol
D.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
参考答案:D
本题解析:A.反应放热,说明反应物总能量大于生成物总能量,A错误。
B.1mol氢分子含有2mol氢原子,故其具有的能量为2mol氢原子的总能量,E2=2E1,B错误。
C.液态水转化为气态水要吸热,故生成气态水放出的热量要少,但△H要大,C错误。
D.利用太阳能等清洁能源代替化石燃料,利于节约资源、保护环境,正确。
故选D
本题难度:一般
4、选择题 肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知:
N2(g)+2O2(g)=2NO2(g)????????????????ΔH=+67.7kJ/mol,
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ????ΔH=-1135.7kJ/mol,
下列说法正确的是
A.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-1068 kJ/mol
B.肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4 + H2O=N2H5++ OH-
C.铂做电极,以KOH溶液为电解质溶液的肼—空气燃料电池,放电时的负极反应式:N2H4-4e-+4OH-=N2↑+4H2O
D.铂做电极,以KOH溶液为电解质溶液的肼—空气燃料电池,工作一段时间后,KOH溶液的pH将增大
参考答案:C
本题解析:(1)N2(g)+2O2(g)=2NO2(g)? ΔH="+67.7kJ/mol," ;(2)2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ΔH=-1135.7kJ/mol,根据盖斯定律,[(1)+(2)]/2知,A错;N2H4不能电离得到OH-,B错;根据负极反应原理及碱性环境,C正确;铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,工作一段时间后,OH-的物质的量不变,但生成水,所以KOH溶液的pH减少。
本题难度:一般
5、选择题 下列表示化学反应2H2(g)+ O2(g)= 2H2O(g)过程能量变化的示意图中,合理的是
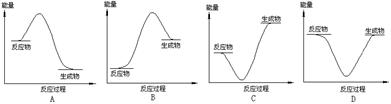
参考答案:A
本题解析:
试题分析:2H2(g)+ O2(g)= 2H2O(g)的放热反应,反应物的能量高,生成物的能量低,多余的能量就释放出来。符合题意的图示为A。
本题难度:一般
|