微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mlo-1、-1411.0kJ·mlo-1和-1366.8kJ,则由C2H4(g)和H2O(I)反应生成C2H5OH(I)的△H为
A.-44.2kJ·mol-1
B.+44.2kJ·mlo-1
C.-330kJ·mol-1
D.+330kJ·mlo-1
参考答案:A
本题解析:根据题意可知,①C2H4(g)+3O2(g)=2CO2(g)+2H2O(l)?ΔH= -1411.0kJ/mol,②C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(l)?ΔH= -1366.8kJ/mol。根据盖斯定律可知,①-②即得到C2H4(g)+H2O(I)=C2H5OH(1),所以反应热是-1411.0kJ/mol+1366.8kJ/mol=-44.2kJ/mol,答案选A。
本题难度:简单
2、选择题 下列说法中不正确的是[???? ]
A.任何化学反应都伴随着热量的变化
B.化学反应的特征是有新物质生成
C.经过加热而发生的化学反应不一定都是吸热反应
D.只要有化学键的断裂,一定发生化学反应
参考答案:D
本题解析:
本题难度:简单
3、填空题 从能量的变化和反应的快慢等角度研究反应: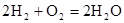 。
。
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同)。
A.使用催化剂
B.适当提高氧气的浓度
C.适当提高反应的温度
D.适当降低反应的温度
(2)已知该反应为放热反应,下图能正确表示该反应中能量变化的是________。
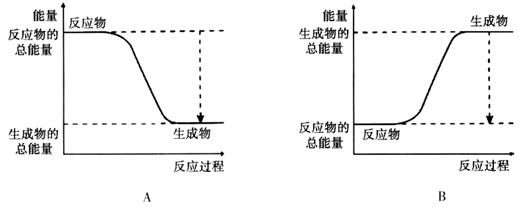
(3)从断键和成键的角度分析上述反应中能量的变化。
【资料】①键能:拆开1mol化学键需要吸收的能量,或是形成1mol化学键所放出的能量称为键能。
②化学键的键能:??
化学键
| H—H
| O=O
| H—O
|
键能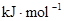
| 436
| 496
| 463
?
请填写下表:
化学键
| 填“吸收热量”
或“放出热量”
| 能量变化
| 拆开化学键
| 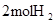 中的化学键 中的化学键
| _______________
| _______________
| 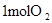 中的化学键 中的化学键
| 形成化学键
| 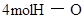 键 键
| _______________
| _______________
| 总能量变化
| _______________
| _______________
(4)氢氧燃料电池的总反应方程式为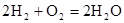 。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。 。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。
参考答案:(1)ABC?(2)A
(3)
化学键
填
本题解析:
试题分析:(1)A、B、C均为增大反应速率的方法,D为减小反应速率。
(2)该反应为放热反应,反应物的总能量大于生成物的总能量。
(3)打破2molH2需要吸收2mol×436KJ/mol=872KJ;打破1molO2需要吸收1mol×496KJ/mol=496KJ
则共需要能量872KJ+496KJ=1368KJ能量;形成4molH-O键能够放出4mol×463KJ/mol=1852KJ;故总能量变化为1852KJ-1368KJ=484KJ。
(4)H2在反应中失去电子,
本题难度:一般
4、选择题 已知化学能与其他形式的能可以相互转化,下列反应中能量的转化形式是由化学能转化为热能的是
A.CH4+2O2 CO2+2H2O CO2+2H2O
B.CaCO3 CaO+CO2↑ CaO+CO2↑
C.2H2O  2H2↑ + O2↑ 2H2↑ + O2↑
D.Pb+PbO2+2H2SO4  2PbSO4+2H2O 2PbSO4+2H2O
参考答案:A
本题解析:
试题分析:CH4+2O2 ?CO2+2H2O 为燃烧反应,是化学能转化为热能,所以A正确;CaCO3 ?CO2+2H2O 为燃烧反应,是化学能转化为热能,所以A正确;CaCO3 ?CaO ?CaO
本题难度:一般
5、选择题 下列说法中错误的是(??)
A.凡是放热反应和熵增加的反应,就更易自发进行
B.对于同一物质在不同状态时的熵值是:气态>液态& gt;固态
C.平衡常数K值越大,则可逆反应进行越完全,反应物的转化率也越大
D.凡是能量达到活化能的分子发生的碰撞均为有效碰撞
参考答案:D
本题解析:略
本题难度:简单
|
|