微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用来表示可逆反应:2A(g)+B(g)?3C(g)(正反应放热)的正确图象是图中的( )
A.
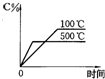
B.

C.

D.
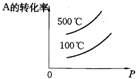
参考答案:A
本题解析:
本题难度:简单
2、选择题 已知ΔH大于0表示吸热反应;ΔH小于0表示放热反应。关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节诱发关节疼痛,其化学机理为:①HUr(尿酸)+H2O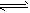 Ur-(尿酸根离子)+H3O+;
Ur-(尿酸根离子)+H3O+;
②Ur-(aq)+Na+(aq) NaUr(s) 下列对反应②的叙述中正确的是[???? ]
NaUr(s) 下列对反应②的叙述中正确的是[???? ]
A.反应的ΔH>0
B.降低温度,平衡向逆反应方向移动
C.反应的ΔH<0
D.升高温度,平衡向正反应方向移动
参考答案:C
本题解析:
本题难度:一般
3、填空题 氯气在298 K、100 kPa时,在1 L水中可溶解0. 09 mol,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
(1)该反应的离子方程式为________________;
(2)估算该反应的平衡常数_____________ (列式计算);
(3)在上述平衡体系中加入少量NaOH固体,平衡将向_____________移动;
(4)如果增大氯气的压强,氯气在水中的溶解度将_________ (填“增大”、“减小”或“不变”),平衡将向________ 移动。
参考答案:(1)Cl2+H2O![]() 本题解析:
本题解析:
本题难度:一般
4、选择题 在一定温度下,可逆反应A(气)+3B(气)  2C(气)达到平衡的标志是( )
2C(气)达到平衡的标志是( )
A.A、B、C的分子数比为132
B.A、B、C的浓度相等
C.C生成的速率与C分解的速率相等
D.单位时间生成n mol A,同时生成3n mol B
参考答案:C
本题解析:
试题分析:对于一个可逆反应,达到化学平衡的特征为1.正反应速率等于逆反应速率。2.各物质的浓度保持不变。A选项,各物质在达到化学平衡时不一定是按化学计量数的比例存在。所以A选项是错误的。B选项是各物质的浓度保持不变,不是相等,所以B 选项是错误的。D应该为单位时间生成n mol A,同时消耗3n mol B
考点:考查判断一个可逆反应达到平衡标志的相关知识点。
本题难度:一般
5、填空题 (16分)(一)某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,通过测定褪色所需时间来判断反应的快慢。限选试剂与仪器:0.20mol/LH2C2O4溶液,0.010mol/L 酸性KMnO4溶液,蒸馏水,锥形瓶,恒温水浴槽,量筒,秒表。该小组设计了如下的方案。