微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应是:A(g)+xB(g) 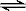 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。
下列说法中正确是
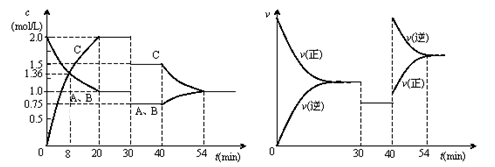

A.在一定条件下,当 v(正)A :v(逆)C=1:2时的状态即为化学平衡状态
B.20min时A的反应速率为0.05mol/(L·min)
C.反应方程式中的x=1,正反应为吸热反应
D.30min时降低温度,40min时升高温度
2、填空题 (1)一定条件下的密闭容器中,反应3H2(g)+3CO(g) CH3OCH3(二甲醚)(g)+CO2(g) ΔH<0达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
CH3OCH3(二甲醚)(g)+CO2(g) ΔH<0达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
a.升高温度 b.加入催化剂 c.减小CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(2)已知反应②2CH3OH(g) CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质
| CH3OH
| CH3OCH3
| H2O
|
浓度/(mol·L-1)
| 0.44
| 0.6
| 0.6
①比较此时正、逆反应速率的大小:v(正) v(逆)(填“>”“<”或“=”)。
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)= ;该时间内反应速率v(CH3OH)= 。
3、填空题 (15分)Ⅰ.在一个容积固定为2L的密闭容器中,发生反应:aA (g) + bB(g)  pC(g) △H=?反应情况记录如下表: pC(g) △H=?反应情况记录如下表:
|