微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某学生配制一定物质的量溶度的氢氧化钠溶液时,造成所配溶液浓度偏高的原因是( )
A.所用NaOH已潮解
B.所用NaOH中含有NaCl杂质
C.向容量瓶加水定容,俯视刻度线
D.容量瓶用蒸馏水洗涤完后,未用氢氧化钠润洗
参考答案:A、所用NaOH已潮解,实际称量的氢氧化钠的质量偏小,氢氧化
本题解析:
本题难度:一般
2、填空题 在标准状况下,由CO和CO2组成的混合气体8.96 L,质量为16g,则此混合物中CO和CO2物质的量之比是 ,C和O原子个数比是 ,对氢气的相对密度是 ,与该混合气体所含碳原子数相同的CH4的质量为 。
参考答案:(8分)
1:3,4:7,20,6.4g。(每空2分)
本题解析:
试题分析:设CO和CO2组成的混合气体中CO的物质的量是x,CO2的物质的量是y,则x+y=8.96L/22.4L/mol,28g/mol×x+44g/mol×y=16g,解得x=0.1mol,y=0.3mol,所以CO和CO2物质的量之比是0.1mol:0.3mol=1:3;其中C原子的物质的量是0.1mol+0.3mol=0.4mol,O原子的物质的量是0.1mol+0.3mol×2=0.7mol,所以C和O原子个数比也是物质的量之比是0.4mol:0.7mol=4:7,该混合气体的平均相对分子质量是28×1/(1+3)+44×3/(1+3)=40,所以该混合气体相对于氢气的密度等于该混合气体的平均相对分子质量与氢气的相对分子质量的比值为40/2=20;该混合气体的C原子的物质的量是0.4mol,所以甲烷的物质的量是0.4mol,则甲烷的质量是0.4mol×16g/mol=6.4g。
考点:考查物质的量、质量、气体体积、粒子数、相对密度的计算
本题难度:一般
3、选择题 在标准状况下,将V L气体A(摩尔质量为M g·mol-1)溶于0.1L水中,所得溶液密度为d g·cm-3,则该溶液的物质的量浓度为 [???? ]
A.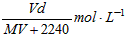
B.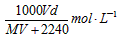
C.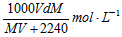
D.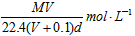
参考答案:B
本题解析:
本题难度:简单
4、实验题 (14分)实验室需要0.80mol/LNaOH溶液475mL和0.40mol/L硫酸溶液500mL。根据这两种溶液的配置情况回答下列问题:
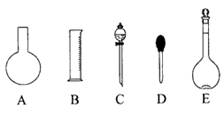
(1)如图所示的仪器中配制溶液肯定不需要的是 (填序号),配制上述溶液还需用到的玻璃仪器是 (填仪器名称)。
(2)下列操作中,容量瓶所不具备的功能有 (填序号。)
A.配制一定体积准确浓度的标准溶液
B.量取一定体积的液体
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液。
E.贮存溶液
F.用来加热溶解固体溶质
(3)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体为 mL(保留一位小数)。如果实验室有10mL、15mL、20mL、50mL量筒,应选用 mL量筒最好。
(4)根据计算用托盘天平称取NaOH的质量为 g。在实验中其他操作均正确,若定容时俯视视刻度线,则所得溶液浓度 0.8 mol/L(填“大于”、“等于”或“小于”,下同)。若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度 0.8 mol/L。
参考答案:(1)A、C 烧杯,玻璃棒(4分) (2) C、D
本题解析:
试题分析:(1)实验室配制一定体积、一定物质的量浓度的溶液,需要使用的仪器有天平、药匙、量筒、烧杯、玻璃棒、容量瓶、胶头滴管。故如图所示的仪器中配制溶液肯定不需要的是烧瓶和分液漏斗,选项是A、C;配制上述溶液还需用到的玻璃仪器是烧杯,玻璃棒;(2)容量瓶所具备的功能是A.配制一定体积准确浓度的标准溶液;B.量取一定体积的液体,不具备是功能是C.测量容量瓶规格以下的任意体积的液体;D.准确稀释某一浓度的溶液;E.贮存溶液;F.用来加热溶解固体溶质。故选项是C、D、E、F。(3)质量分数为98%、密度为1.84 g/cm3的浓硫酸的物质的量浓度是C=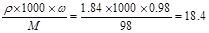 mol/L溶液在稀释前后溶质的物质的量不变。由于有500mL的容量瓶,所以根据稀释公式C1?V1=C2?V2可得V1= (C2?V2)÷C1="(0.40mol/L×500mL)" ÷18.4mol/L=10.9ml。仪器在使用使,规格与量取的物质的体积越接近,误差就越小,所以应选用15mL的量筒;(4)与475mL最接近的容量瓶的规格是500mL的容量瓶,所以应该配制500mL的NaOH溶液,根据溶液的均一性可知,用托盘天平称取NaOH的质量为m(NaOH)= 0.80mol/L×0.5L×40g/mol=16.0g;在实验中其他操作均正确,若定容时俯视视刻度线,则溶液的体积偏小,会使所得溶液浓度偏高,大于0.8 mol/L;若定容时,有少许蒸馏水洒落在容量瓶外,由于溶质的质量不变,溶剂的体积也不变,因此对所得溶液浓度无影响,等于0.8 mol/L。
mol/L溶液在稀释前后溶质的物质的量不变。由于有500mL的容量瓶,所以根据稀释公式C1?V1=C2?V2可得V1= (C2?V2)÷C1="(0.40mol/L×500mL)" ÷18.4mol/L=10.9ml。仪器在使用使,规格与量取的物质的体积越接近,误差就越小,所以应选用15mL的量筒;(4)与475mL最接近的容量瓶的规格是500mL的容量瓶,所以应该配制500mL的NaOH溶液,根据溶液的均一性可知,用托盘天平称取NaOH的质量为m(NaOH)= 0.80mol/L×0.5L×40g/mol=16.0g;在实验中其他操作均正确,若定容时俯视视刻度线,则溶液的体积偏小,会使所得溶液浓度偏高,大于0.8 mol/L;若定容时,有少许蒸馏水洒落在容量瓶外,由于溶质的质量不变,溶剂的体积也不变,因此对所得溶液浓度无影响,等于0.8 mol/L。
考点:考查物质的量浓度的溶液配制仪器的使用、选择及功能、溶液体积、质量的计算、误差分析的知识。
本题难度:一般
5、选择题 用NA表示阿伏加德罗常数的值,下列叙述正确的是(???)
A.含有NA个氮原子的氮气在标准状况下的体积约为22.4L
B.25℃,1.01×105Pa,64gSO2中含有的原子数为3NA
C.在常温常压下,11.2L Cl2含有的分子数为0.5NA
D.标准状况下,11.2LH2O含有的分子数为0.5NA
参考答案:B
本题解析:含有NA个氮原子的氮气是0.5mol,在标准状况下的体积约为11.2L,A不正确。64gSO2是1mol,含有3mol原子,B正确。在常温常压下,11.2L Cl2不是0.5mol,C不正确。标准状况下,水不是气体,D不正确。答案选B。
本题难度:一般