微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列变化中,属于原电池反应的是
A.在空气中,金属铝表面迅速氧化形成保护层
B.白铁(镀锌)表面有划伤时,也能阻止铁被氧化
C.红热的铁丝与水接触,表面形成蓝黑色的保护层
D.在空气中,金属银表面生成一层黑色物质
参考答案:B
本题解析:A?生成了一层氧化铝保护膜。不属于原电池
B 锌、铁形成原电池,锌做负极,能保护正极铁被氧化
C 铁和水蒸气反应生成四氧化三铁,表面形成蓝黑色的保护层,不属于原电池
D金属银表面生成一层黑色物质是氧化银,不属于原电池
故选B。
本题难度:一般
2、选择题 根据下图所示的装置,判断下列说法正确的是(?)
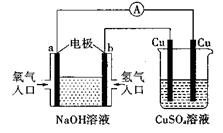
A.该装置中a极为负极
B.当装置中某一块铜片的质量变化了12.8g时,a极上消耗O2在标准状况下的体积为4.48L
C.该装置中b极的电极反应式是:H2-2e-=2H+
D.一段时间后,左边装置中溶液pH减小
参考答案:D
本题解析:原电池中负极失去电子,正极得到电子,所以氢气在负极通入,氧气在正极通入,即a是正极,b是负极,A不正确。12.8g铜0.2mol,转移电子是0.4mol,所以根据电子得失守恒可知,消耗氧气是0.1mol,标准状况下的体积是2.24L,B不正确。原电池中电解质是氢氧化钠,负极反应式应该是H2-2e-+2OH-=2H2O,C不正确。选项D中生成水,氢氧化钠的浓度降低,pH减小,D正确,答案选D。
本题难度:一般
3、选择题 发生原电池的反应通常是放热反应,下列反应在理论上可设计成原电池的是
A.C+CO2=2CO
B.Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3·H2O+8H2O
C.CaC2+2H2O=Ca(OH)2+C2H2
D.CH4+ 2 O2= CO2 + 2H2O
参考答案:D
本题解析:原电池必须有电子的转移,所以只有氧化还原反应才能设计成原电池,A是吸热反应,B和D是非氧化还原反应,所以正确的答案是D。
本题难度:简单
4、填空题 金属铜不溶于稀硫酸,但可溶于铁盐溶液。现将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化)。
(1)写出铜溶解于上述混合溶液的离子方程式_______________________________________。
(2)若铜完全溶解时,溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶解铜的质量是_________g,溶液中的c(SO42—)=__________mol/L。
(3)若欲在如图所示的装置中发生(1)中的反应,则:X极是 (正、负极),电极反应式 。Y极的材料是 ,电极反应式 。
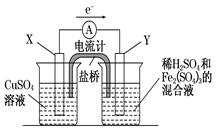
参考答案:(1)Cu+2Fe3+=Cu2++2Fe2+(2分)
本题解析:
试题分析:(1)铜和铁离子反应生成亚铁离子和铜离子,离子反应方程式为:Cu+2Fe3+
本题难度:一般
5、填空题 (7分)氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用。
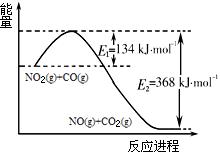
(1)根据右侧能量变化示意图,请写出NO2和CO反应的热化学方程式??????????????。
(2)在固定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g) 2NH3(g)?△H < 0?,其平衡常数K与温度T的关系如下表:
2NH3(g)?△H < 0?,其平衡常数K与温度T的关系如下表:
T/K
| 298
| 398
| 498
|
平衡常数K
| 4.1×106
| K1
| K2
?
①该反应的平衡常数表达式:K= ??????????
②试判断K1??????K2(填写“>”,“=”或“<”)
③下列各项能说明该反应已达到平衡状态的是???????(填字母)
a.容器内N2、H2、NH3的浓度之比为1∶3∶2
b.v(N2)正 = 3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(3)对反应N2O4(g) 2NO2(g)?△H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是???????????。 2NO2(g)?△H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是???????????。
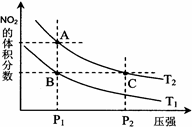
a.A、C两点的反应速率:A>C????
b.A、C两点的化学平衡常数:A>C
c.A、C两点N2O4的转化率:A>C
d.由状态B到状态A,可以用加热的方法
参考答案:(7分)(1)NO2(g)+CO(g)=NO(g)+CO2(
本题解析:
试题分析:(1)根据图像可知,反应中放出的热量是134kJ/mol-268kJ/mol=-234kJ/mol,所以该反应的热化学方程式是NO2(g)+CO(g)=NO(g)+CO2(g)????? ΔH=234kJ/mol。
(2)①化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的化学方程式可知,该反应的平衡常数表达式是K=C2(NH3)/C(N2).C3(H2)。
②正反应是放热反应,升高温度,平衡向逆反
本题难度:一般
|