微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (13分) CuSO4·5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。
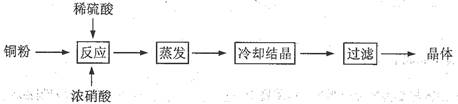
根据题意完成下列填空:
(1)向含铜粉的稀硫酸中滴加浓硝酸,在铜粉溶解时可以观察到的实验现象:???????????????????、????????????????????????????。
(2)有同学认为此种方法会生成有毒的氮的氧化物, 且所得晶体可能混有硝酸铜。建议将浓硝酸换成其它氧化剂,你觉得呢?若有同感,请选择合适的试剂完成下列反应(若有反应条件的应注明):
__Cu + __H2SO4 + __________→ __CuSO4 +_______________
(3)已知:CuSO4+2NaOH=Cu(OH)2↓+ Na2SO4
相对分子质量:CuSO4:160?????? H2O:18
称取0.1000 g提纯后的CuSO4·5H2O试样于锥形瓶中,加入0.1000 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用0.1000 mol/L盐酸滴定至终点,耗用盐酸20.16 mL,则该试样中含CuSO4·5H2O的质量分数为????????。
(4)上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用??????????????????????????????????????????。
(5)如果采用重量法测定CuSO4·5H2O的含量,完成下列步骤:
①称取样品a g②加水溶解③加氯化钡溶液,沉淀④过滤、????????、干燥⑤称量所得固体b g。
在过滤前,需要检验是否沉淀完全,其操作是???????????????????????????
则a g该试样中含CuSO4·5H2O的质量为??????????????g (用含b的代数式表示)。
[相对原子质量:H-1?? O-16? S-32?? Ba-137]
参考答案:(1)溶液呈蓝色,有红棕色气体生成2分
![]()
本题解析:略
本题难度:一般
2、填空题 某研究所对含硫酸亚铁和硫酸铜的工业废料进行相关的研究。实验过程如下:
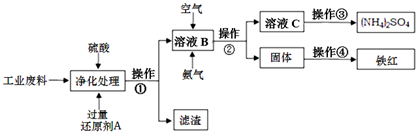
回答下列问题:
(1)滤渣的成分为????????????,操作①的名称为????????????。
(2)上图溶液B中所发生反应的离子方程式为??????????????????。
(3)实验要求向溶液B中通入过量的空气,证明通入空气过量的方法是???????????。
(4)操作③第一步需要的仪器除了酒精灯、铁架台外,还需要?????????、?????????。
(5)某同学利用下面装置制备氢气并利用氢气还原某金属氧化物,根据要求回答问题。
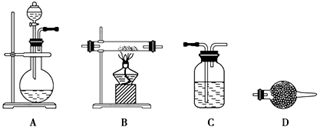
①请设计一个实验方案验证H2的还原性并检验其氧化产物,其装置连接顺序是A→_____→_____→_____→D(除D装置外,其它装置不能重复使用),最后D装置中所加药品为____________,其作用是___________________。
②点燃B处酒精灯之前必须进行的操作是____________________。
参考答案:(1)Fe、Cu;过滤(2)4Fe2++O2+8NH3+10
本题解析:
试题分析:(1)向含有硫酸亚铁和硫酸铜的工业废料中加入过量的稀硫酸来溶解该混合物,防止硫酸亚铁和硫酸铜的水解。然后加入过量的还原铁粉,发生反应:CuSO4+Fe=FeSO4+Cu, Fe+H2SO4=FeSO4+H2↑.所以过滤得到的滤渣主要成分是置换出来的Cu和过量的Fe粉。滤液的成分是FeSO4。(2)向滤液中加入足量的氨气,发生反应:FeSO4+2NH3+2H2O=Fe(OH)2↓+ (NH4)2SO4. 再通足量的空气,发生反应:4Fe(OH)2+O2+2H2O=4Fe(OH)3.总反应方
本题难度:一般
3、填空题 铜是重要的金属材料。
(1)工业上可用Cu2S和O2反应制取粗铜,该反应中氧化剂为________。电解粗铜制取精铜,电解时,阳极材料是________,电解液中必须含有的阳离子是________。
(2)在100 mL 18 mol·L-1浓硫酸中加入过量的铜片,加热使之充分反应,反应中被还原的H2SO4为________mol。
(3)电子工业曾用质量分数为30%的FeCl3溶液腐蚀敷有铜箔的绝缘板制印刷电路板,为了从使用过的废腐蚀液中回收铜,并重新得到FeCl3溶液,设计如下实验流程。

上述流程中,所加试剂的化学式为:X________,Y________,Z________;第⑥步反应的离子方程式为
___________________________________________________。
参考答案:(1)O2 粗铜 Cu2+
(2)小于0.9
(
本题解析:用30%的FeCl3溶液腐蚀有铜箔的绝缘板印刷电路板时发生反应:2Fe3++Cu=2Fe2++Cu2+,废液中会含有Fe2+、Cu2+、Fe3+;加入铁粉后,2Fe3++Fe=3Fe2+、Fe+Cu2+=Cu+Fe2+;滤渣中含有过量的Fe和Cu,加入盐酸:Fe+2HCl=FeCl2+H2↑;通入Cl2后,2FeCl2+Cl2=2FeCl3。
本题难度:一般
4、选择题 向2mL 、0.5mol/L的FeCl3溶液中加入3mL 、3mol/L KF溶液,结果FeCl3溶液褪成无色,向褪色后的溶液中继续加入KI溶液和CCl4振荡后静置,CCl4层不显色,则下列说法正确的是(???)
A.Fe3+ 不与I-发生反应
B.Fe3+ 与F- 结合成不与I- 反应的物质
C.F- 使I- 的还原性减弱,因而不反应
D.Fe3+ 被F- 还原为Fe2+,使溶液中不再存在Fe3+
参考答案:B
本题解析:由题意可知,向FeCl3溶液中加入过量的KF溶液后,溶液褪色,说明Fe3+ 已经与F- 生成了新物质,但不可能发生氧化还原反应,因为F- 的还原性极差,Fe3+ 不可能氧化它;再者,向褪色后的溶液中继续加入KI溶液和CCl4振荡后静置,CCl4层不显色,说明Fe3+ 与F- 结合生成的新物质不能氧化I- ,或者说不与I- 反应,故答案为B
本题难度:一般
5、选择题 下列关于铁的描述中,不正确的是??????????????????????????????????????????????????????????????????????????????(??)
A.在FeSO4中滴入KSCN溶液,溶液显红色
B.铁位于元素周期表中第4周期Ⅷ族
C.在化合物中,铁元素常呈现为+2、+3价
D.通常情况下,铁丝在氯气里燃烧时生成FeCl3
参考答案:A
本题解析:略
本题难度:简单