b
a
)
参考答案:室温时,M(OH)2(s)?M2+(aq)+2OH-(aq)
本题解析:
本题难度:一般
2、选择题 下列说法正确的是(???? )
A.25℃时,向饱和AgCl水溶液中加入盐酸,Ksp值变大
B.25℃时,向CaCO3饱和溶液通入CO2,有沉淀生成
C.25℃时,AgCl水溶液中,c(Ag+)和c(Cl-)的乘积是一个常数
D.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
参考答案:D
本题解析:
试题分析: Ksp 只与温度有关,温度不变Ksp 值不变,所以A错误;B项中的碳酸钙溶液已经达饱和状态,通入二氧化碳,没有沉淀生成,B错误;C项中的氯化银水溶液不一定是饱和的,所以c(Ag+)和c(Cl-)的乘积不一定是一个常数,C错误;在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,NH4+与OH-结合生成了可溶的一水合氨,使得Mg(OH)2的溶解平衡向右移动,使c(Mg2+)增大,D正确,故选D。
本题难度:一般
3、选择题 常温下,Ag2SO4、AgCl、AgI的溶度积常数依次为:Ksp(Ag2SO4)=7.7×10-5?mol3?L-3、Ksp(AgCl)=1.8×10-10?mol2?L-2、Ksp?(AgI)=8.3×10-17?mol2?L-2.下列有关说法中,错误的是( )
A.常温下,Ag2SO4、AgCl、AgI在水中溶解能力依次减小
B.在AgCl饱和溶液中加入NaI固体,有AgI沉淀生成
C.Ag2SO4、AgCl、AgI的溶度积常数之比等于它们饱和溶液的物质的量浓度之比
D.在Ag2SO4饱和溶液中加入Na2SO4固体有Ag2SO4沉淀析出
参考答案:A、在Ag2SO4饱和溶液中,Ksp(Ag2SO4)=7.7
本题解析:
本题难度:简单
4、选择题 氢氧化镁固体在水中溶解,有下列平衡:Mg(OH)2(s) Mg2++ 2OH―,加入下列哪种固体物质可使Mg(OH)2固体的质量减少 Mg2++ 2OH―,加入下列哪种固体物质可使Mg(OH)2固体的质量减少
A.Na2CO3
B.MgCl2
C.NH4Cl
D.NaCl
参考答案:C
本题解析:A 加入碳酸钠固体,碳酸根离子水解显碱性,使氢氧化镁的沉淀溶解平衡左移,Mg(OH)2固体的质量增加。
B 加入氯化镁,镁离子浓度增大,沉淀溶解平衡左移,Mg(OH)2固体的质量增加
C 加入氯化铵固体,铵根离子水解显酸性,沉淀溶解平衡右移,Mg(OH)2固体的质量减少。
D 加入氯化钠固体,平衡不移动,Mg(OH)2固体的质量不变。
本题难度:一般
5、填空题 孔雀石主要含Cu2(OH)2CO3,还含少量铁的化合物和硅的化合物。以孔雀石为原料可制备CuCl2·3H2O及纯碱,流程如图所示。
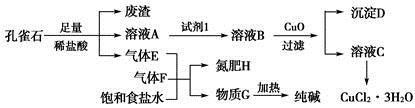
已知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀时的pH如表所示。回答下列问题:
金属离子
| Fe3+
| Fe2+
| Cu2+
| pH
| 氢氧化物
开始沉淀
| 1.9
| 7.0
| 4.7
| 氢氧化物
完全沉淀
| 3.2
| 9.0
| 6.7
(1)图中“试剂1”为________。
(2)加入CuO的作用是调节溶液pH,则pH的范围为________。
(3)气体E、F与饱和食盐水作用生成H和G时,E和F应按一定先后顺序通入饱和食盐水中。其中,应先通入的气体是________(填代号及对应物质的化学式)。
(4)由溶液C获得CuCl2·3H2O,需要经过__________、________、过滤等操作。
(5)已知:常温下Cu(OH)2的Ksp=2×10-20。计算Cu2++2H2O Cu(OH)2+2H+的平衡常数为________。 Cu(OH)2+2H+的平衡常数为________。
参考答案:(1)Cl2或H2O2
(2)3.2≤pH<4.
本题解析:(1)Fe2+开始沉淀时的pH为7.0,此时Cu2+已完全沉淀。所以欲除去Cu2+中混有的Fe2+时,必须先将其氧化为Fe3+。为避免引入新杂质,试剂1可以是氯气或H2O2。
(2)调节pH的原则是使Fe3+完全沉淀而Cu2+不沉淀。
(3)CO2在饱和食盐水中的溶解度小,因此必须先通入NH3。
(5)Cu2++2H2O Cu(OH)2+2H+的平衡常数 Cu(OH)2+2H+的平衡常数 。根据Ksp[Cu(OH)2]=c(Cu2+)·c2(OH-)及常温下Kw=c(H+)·c(OH-)得: 。根据Ksp[Cu(OH)2]=c(Cu2+)·c2(OH-)及常温下Kw=c(H+)·c(OH-)得: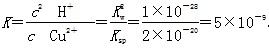
本题难度:困难
|
|