微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的情况下加入一种试剂,过滤后,再加入适量的盐酸,这种试剂是( )
A.NH3?H2O
B.NaOH
C.Na2CO3
D.MgO
2、填空题 我省许多地方都有石灰石矿,有很多用石灰岩制石灰的企业。烧制石灰时,在800℃高温下密闭的石灰窑内存在下列平衡:CaCO3(s) CaO(s)+CO2(g);平衡常数K=c(CO2)=0.003
CaO(s)+CO2(g);平衡常数K=c(CO2)=0.003
(1)将CO2(g)、CaCO3(s)和CaO(s)按下列A、B两种不同的投料方式,放入一个10 L密闭容器中
经过足够长时间且维持温度不变,按A种投料方式,容器中CaCO3(s)的物质的量为____mol;按B种投料方式,容器中CaCO3(s)的物质的量为____mol。
(2)美丽的珊瑚和珍珠的主要成分都是碳酸钙,有人用石膏(CaSO4·2H2O)作原料制成了一种红色的“珊瑚礁”,假冒珊瑚出售。请设计一个简单的实验方案区分真假珊瑚礁____。
(3)锅炉水垢中含有较难溶于水又较难溶于酸的CaSO4,可先用碳酸钠溶液处理,使之转化为疏松、易溶于酸的物质,该转化的化学反应方程式是____________________。
3、填空题 (14分,每空2分))镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2?碳粉?氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
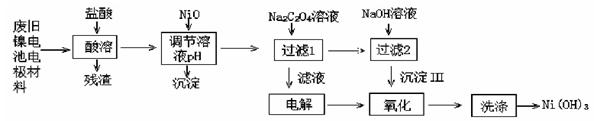
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4> NiC2O4·H2O > NiC2O4·2H2O
③Ksp[Ni(OH)2]=5.0×10-16, Ksp(NiC2O4)=5.0×10-10;
回答下列问题:
(1)酸溶后所留残渣的主要成分为 (填物质名称)。
(2)用NiO调节溶液的pH,析出沉淀的成分为 (填化学式)。
(3)写出加入Na2C2O4溶液后反应的化学方程式: 。
(4)写出加入NaOH溶液所发生反应的离子方程式: 。
(5)电解过程中阴极反应式 ,沉淀Ⅲ可被电解所得产物之一氧化,写出氧化反应的离子方程式 。
(6)铁镍蓄电池,放电时总反应为:
Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是
A.电池的电解液为碱性溶液,正极为Ni2O3?负极为Fe
B.电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O
4、选择题 要使工业废水中的Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂,已知Pb2+与这些离子形成的化合物的溶解度如下,由以下数据可知,沉淀剂最好选用
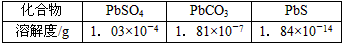 [???? ]
[???? ]
A.硫化物
B.硫酸盐
C.碳酸盐
D.以上沉淀剂均可
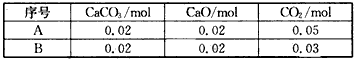
5、选择题 25℃是,CaCO3在水中的溶解平衡曲线如图所示,已知该温度下其溶度积为2.8×10-9.下列说法错误的是( )
提示:CaCO3(s)?Ca2+(s)+CO32-(s)的溶度积常数Ksp=c(Ca2+)c(CO
2-3
),不考虑水解等因素.
A.x数值为2×10-5
B.c点时有碳酸钙沉淀生成
C.加入蒸馏水可使溶液由d点变到a点
D.b点与d点对应的溶度积相等