微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)短周期元素W、X、Y、Z在元素周期表中的位置如图所示。
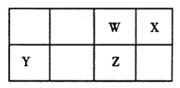
其中Z的单质是一种重要半导体材料,广泛应用于电子工业的各个领域。
(1)W在元素周期表中的位置是 。
(2)Z的原子结构示意图为 。
(3)下列选项中,能证明元素非金属性X强于W的是 。
A.原子序数:X>W
B.最低化合价:X>W
C.最简单氢化物的稳定性:X>W
D.最高价氧化物的水化物酸性:X>W
(4)元素周期表中与Z同周期的某金属元素形成的单质A,可发生如下图所示的转化:
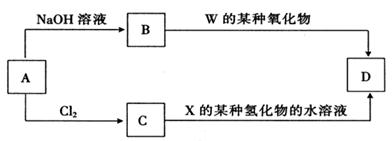
其中化合物D是一种白色沉淀,则B中溶质的化学式为 ;
C转化生成D的离子方程式为 。
(5)表中Y的最高价氧化物对应水化物的化学式为Y(OH)n ,在T℃时,其饱和溶液能使酚酞试液变红,原因是其溶液中的c(OH—) = mol·L—1 (填计算数值,已知:T℃,Ksp[Y(OH) n]=4.0×l0-12)。
参考答案:(10分)
(1)第二周期第IVA族 (2分) (2)
本题解析:
试题分析:Z的单质是一种重要半导体材料,广泛应用于电子工业的各个领域,Z为Si元素;根据短周期元素W、X、Y、Z在元素周期表中的位置可知W为C元素、X为N元素、Y为Mg元素。
(1)W为C元素,所以W在元素周期表中的位置是:第二周期第IVA族。
(2)Z为Si元素,原子序数为14,所以Si原子结构示意图为: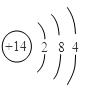
(3)A、没有同周期或同主族等条件,根据原子序数的大小,无法判断非金属性的强弱,错误;B、没有同周期等条件,根据最低化合价无法判断非金属性的强弱,错误;C、最简单氢化物的稳定性越强,元素的非金属性越强,正确;D、最高价氧化物的水化物酸性越强,元素的非金属性越强,正确。
(4)A为金属单质,能与NaOH溶液反应,则A为Al、B为CO2、C为AlCl3、D为Al(OH)3,所以 Al与NaOH溶液反应生成的B为NaAlO2;AlCl3与NH3?H2O反应生成Al(OH)3,离子方程式为:Al3++3NH3?H2O = Al(OH)3↓+3NH4+。
(5)Y的最高价氧化物对应水化物的化学式为Mg(OH)2,Ksp[Mg(OH)2]=c(Mg2+)?c2(OH?)=4.0×l0-12,解得c(OH—) = 2.0×10-4。
考点:本题考查元素及物质的推断、结构示意图及方程式的书写、非金属性的判断。
本题难度:困难
2、填空题 下面是利用工业冶炼硫酸铜(含有Fe2+、AsO2-、Ca2+等杂质)提纯制备电镀硫酸铜的生产流程。
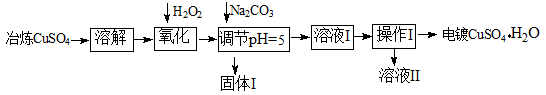
已知:①Fe3+ Cu2+开始沉淀的pH分别2.7、5.4,完全沉淀的pH分别为3.7、6.4;
②KSP[(Cu(OH)2]=2×10-20
(1)溶解操作中需要配制含铜64g/L的硫酸铜溶液100L,需要称量冶炼级硫酸铜的质量至少为 Kg。
(2)氧化步骤中发生的离子反应方程式为①
②AsO2— + H2O2+ H+=H3AsO4 ③ H3AsO4+ Fe3+=FeAsO4↓+ 3H+
(3)若要检验调节pH后溶液的Fe3+是否除尽,方法是 ;氧化后需要将溶液进行稀释,稀释后的溶液中铜离子浓度最大不能超过 mol·L-1。
(4)固体I的主要成分除 FeAsO4外还有 ,操作I为
(5)利用以上电镀级硫酸铜作为电解质溶液,电解粗铜(含铁、银杂质)制备纯铜,写出阳极发生的电极反应方程式
参考答案:(16分)
(1)16 (2分)
本题解析:
试题分析:(1)m(CuSO4)=64g/L×100L÷(64/160)=16000g=16Kg。
(2)溶液中含具有还原性的Fe2+,H2O2与Fe2+发生氧化还原反应,离子方程式为:H2O2+2 H+ +2Fe2+ = 2Fe3+ +2H2O。
(3)Fe3+能与SCN?反应,溶液变为红色,所以检验调节pH后溶液的Fe3+是否除尽,方法是:取少量溶液Ⅰ于试管, 加入几滴KSCN溶液,若溶液不出现红色,则说明Fe3+已经除尽;因为需要把溶液的pH调节至5,即c(OH?)=10-9mol?L?1,根据KSP[(Cu(OH)2]可得Cu2+恰好沉淀时的Cu2+浓度为:c(Cu2+)=2×10-20÷(10-9)2=2×10-2,稀释后的溶液中铜离子浓度最大不能超过2×10-2mol?L?1。
(4)加入Na2CO3后,CO32?与Ca2+反应生成CaCO3沉淀,Fe3+开始沉淀的pH分别2.7,完全沉淀的pH分别为3.7,所以pH调节至5时,Fe3+转化为Fe(OH)3沉淀,所以固体I的主要成分除 FeAsO4外还有Fe(OH)3、CaCO3;根据流程图可知经过操作I得到电镀硫酸铜和溶液II,则操作I为:蒸发浓缩、冷却结晶、过滤干燥。
(5)电解粗铜(含铁、银杂质)制备纯铜,阳极为粗铜,粗铜中Fe与Cu在阳极失去电子,所以阳极发生的电极反应方程式为:Fe—2e—= Fe2+ ;Cu —2e—= Cu2+。
考点:本题考查化学流程的分析、离子方程式的书写、化学计算、电解原理及应用。
本题难度:困难
3、选择题 下列说法中,正确的是
[???? ]
A.难溶电解质在水溶液中达到沉淀溶解平衡时,沉淀和溶解即停止
B.Ksp越小,难溶电解质在水中的溶解能力一定越弱
C.Ksp的大小与离子浓度无关,只与难溶电解质的性质和温度有关
D.相同温度下, AgCl在水中的溶解能力与在NaCl溶液中的相同
参考答案:C
本题解析:
本题难度:一般
4、填空题 牙齿表面由一层硬的成分Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡:
Ca5(PO4)3OH(s) 5Ca2+(aq)+3PO43-(aq) +OH-(aq)
5Ca2+(aq)+3PO43-(aq) +OH-(aq)
进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是_______
???????????????????????????????????。
已知Ca5(PO4)3F的溶解度比上面的矿化物更小,质地更坚固,请用离子方程式表示,当牙膏中配有氟化物添加剂后能防止龋齿的原因_________________________????。
根据以上原理请你提出另外一种促进矿化的方法_______________________???????。
参考答案:H++OH-=H2O,使平衡向脱矿的方向移动;5Ca2++3
本题解析:本是以生活中牙齿的保护这一实例,给出了一个化学平衡体系,要求通过阅读理解,分析出该题的解题关键是平衡移动就只是,从而将平衡移动原理有有关知识迁移到新情景中,此外,设问中又要求我们进一步根据这一原理,回答保护牙齿的一种方法,这们,可以很好地考查学以致用的能力。
本题难度:一般
5、选择题 下列说法正确的是:? [???? ]
A.在100?℃、101?kPa条件下,液态水的气化热为40.69?kJ·mol-1,则H2O(g) ?H2O(l)?的ΔH?=?40.69?kJ·mol-1
?H2O(l)?的ΔH?=?40.69?kJ·mol-1
B.已知MgCO3的Ksp?=?6.82?×?10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)?=?c(CO32-),且c(Mg2+)?·?c(CO32-)?=?6.82?×?10-6
C.已知: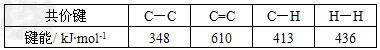 则可以计算出反应
则可以计算出反应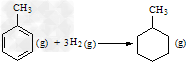 ?的ΔH为-384?kJ·mol-1
?的ΔH为-384?kJ·mol-1
D.常温下,在0.10?mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使NH3·H2O的电离度降低,溶液的pH减小
参考答案:D
本题解析:
本题难度:一般