微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)短周期元素W、X、Y、Z在元素周期表中的位置如图所示。
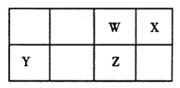
其中Z的单质是一种重要半导体材料,广泛应用于电子工业的各个领域。
(1)W在元素周期表中的位置是 。
(2)Z的原子结构示意图为 。
(3)下列选项中,能证明元素非金属性X强于W的是 。
A.原子序数:X>W
B.最低化合价:X>W
C.最简单氢化物的稳定性:X>W
D.最高价氧化物的水化物酸性:X>W
(4)元素周期表中与Z同周期的某金属元素形成的单质A,可发生如下图所示的转化:
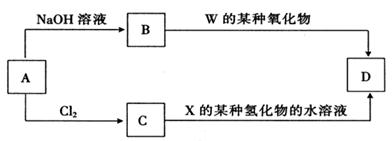
其中化合物D是一种白色沉淀,则B中溶质的化学式为 ;
C转化生成D的离子方程式为 。
(5)表中Y的最高价氧化物对应水化物的化学式为Y(OH)n ,在T℃时,其饱和溶液能使酚酞试液变红,原因是其溶液中的c(OH—) = mol·L—1 (填计算数值,已知:T℃,Ksp[Y(OH) n]=4.0×l0-12)。
2、填空题 下面是利用工业冶炼硫酸铜(含有Fe2+、AsO2-、Ca2+等杂质)提纯制备电镀硫酸铜的生产流程。
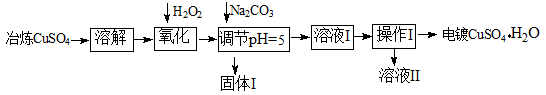
已知:①Fe3+ Cu2+开始沉淀的pH分别2.7、5.4,完全沉淀的pH分别为3.7、6.4;
②KSP[(Cu(OH)2]=2×10-20
(1)溶解操作中需要配制含铜64g/L的硫酸铜溶液100L,需要称量冶炼级硫酸铜的质量至少为 Kg。
(2)氧化步骤中发生的离子反应方程式为①
②AsO2— + H2O2+ H+=H3AsO4 ③ H3AsO4+ Fe3+=FeAsO4↓+ 3H+
(3)若要检验调节pH后溶液的Fe3+是否除尽,方法是 ;氧化后需要将溶液进行稀释,稀释后的溶液中铜离子浓度最大不能超过 mol·L-1。
(4)固体I的主要成分除 FeAsO4外还有 ,操作I为
(5)利用以上电镀级硫酸铜作为电解质溶液,电解粗铜(含铁、银杂质)制备纯铜,写出阳极发生的电极反应方程式
3、选择题 下列说法中,正确的是
[???? ]
A.难溶电解质在水溶液中达到沉淀溶解平衡时,沉淀和溶解即停止
B.Ksp越小,难溶电解质在水中的溶解能力一定越弱
C.Ksp的大小与离子浓度无关,只与难溶电解质的性质和温度有关
D.相同温度下, AgCl在水中的溶解能力与在NaCl溶液中的相同
4、填空题 牙齿表面由一层硬的成分Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡:
Ca5(PO4)3OH(s) 5Ca2+(aq)+3PO43-(aq) +OH-(aq)
5Ca2+(aq)+3PO43-(aq) +OH-(aq)
进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是_______
???????????????????????????????????。
已知Ca5(PO4)3F的溶解度比上面的矿化物更小,质地更坚固,请用离子方程式表示,当牙膏中配有氟化物添加剂后能防止龋齿的原因_________________________????。
根据以上原理请你提出另外一种促进矿化的方法_______________________???????。
5、选择题 下列说法正确的是:? [???? ]
A.在100?℃、101?kPa条件下,液态水的气化热为40.69?kJ·mol-1,则H2O(g) ?H2O(l)?的ΔH?=?40.69?kJ·mol-1
?H2O(l)?的ΔH?=?40.69?kJ·mol-1
B.已知MgCO3的Ksp?=?6.82?×?10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)?=?c(CO32-),且c(Mg2+)?·?c(CO32-)?=?6.82?×?10-6
C.已知: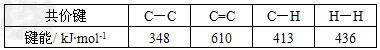 则可以计算出反应
则可以计算出反应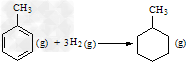 ?的ΔH为-384?kJ·mol-1
?的ΔH为-384?kJ·mol-1
D.常温下,在0.10?mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使NH3·H2O的电离度降低,溶液的pH减小