微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)一定温度时,在容积一定的密闭容器中,反应A(s)+B(g) C(g)+D(g)达到平衡后,升高温度容器内气体的密度增大。请回答下列问题:
C(g)+D(g)达到平衡后,升高温度容器内气体的密度增大。请回答下列问题:
(1)正反应是????????(填“放热”或“吸热”)反应;该反应的化学平衡常数的表达式是?????????????。
(2)能判断该反应一定达到平衡状态的依据是?。(填写字母编号)
A.?体积分数组成C%=D%
B.?单位时间内生成n moAl的同时生成n molC
C.?温度和体积一定是,某一生成物浓度不再变化
D.?温度和体积一定是,容器内压强不再变化
(3)该反应的正反应速率随时间变化的关系如右图所示。
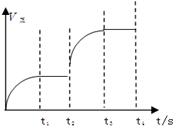
T2时改变了某种条件,改变的条件是?????。(填写字母编号)
A.升温?????????? B.加压???????? C.催化剂???????D.增加A的量
(4)升高温度到T℃时,在一密闭容器中充入2mol A和3mol B,发生上述反应。平衡后测得K=1。然后在温度不变的情况下,扩大容器容积至原来的10倍,结果A的百分含量始终未改变,则此时B的转化率是????????。
参考答案:(1)吸热?? K=[ c(C)·c
本题解析:
试题分析:(1)升高温度容器内气体的密度增大,又容器的体积一定,因此,平衡向正反应方向移动,故正反应为吸热反应,其平衡常数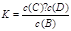 。
。
(2)体积分数组成C%=D%,不能判断反应达到平衡状态。反应达到平衡状态时,正反应速率与逆反应速率相等。
(3)由图像可知,改变条件后,正反应速率增大,且平衡向逆反应方向进行。符合此条件的为C增大压强。
(4)“扩大容器容积至原来的10倍,结果A的百分含量始终未改变”说明此时平衡不发生移动,则B的转化率保持不变。根据“三段式法”计算:设容器的体积为V
A(s)+B(g) C(g)+D(g)
C(g)+D(g)
起始(mol)?? 2??? 3???????? 0???? 0
变化(mol)?? x??? x???????? x???? x??????????????
平衡(mol) 2-x? 3-x?????? x???? x????
 ,
,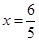 ,此时B的转化率为:
,此时B的转化率为:
点评:本题是对化学平衡的综合考查。对于平衡状态的确定,必须是正逆反应的反应速率相等,即达到平衡状态;对于平衡转化率的计算,应利用三段式法,可以使得计算过程较为有条理性。
本题难度:一般
2、选择题 升高温度,下列数据不一定增大的是(??? )
A.化学平衡常数K
B.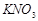 的溶解度s
的溶解度s
C.化学反应速率
D.水的离子积常数Kw
参考答案:A
本题解析:升高温度BCD都是增大的,但平衡的移动方向无法判断,所以平衡常数不一定是增大的,答案选A。
本题难度:简单
3、选择题 在一定温度下,向a L密闭容器中加入1 mol X气体和2 mol Y气体,发生如下反应:X(g) + 2Y(g) 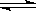 ??2Z(g) ,此反应达到平衡的标志是(??)
??2Z(g) ,此反应达到平衡的标志是(??)
A.容器内压强不随时间变化
B.v正(X)=v逆(Z)
C.容器内X、Y、Z的浓度之比为l:2 :2
D.单位时间消耗0.1 mol X同时生成0.2 mol Z
参考答案:A
本题解析:在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,因此选项C不正确。该反应是体积减小的,则压强也是减小的,所以选项A正确。B中反应速率的方向相反,但反应速率之比不满足相应的化学计量数之比,所以B不正确。D中反应速率的方向是相同的,不正确。所以正确的答案选A。
本题难度:简单
4、选择题 在密闭容器中进行如下反应:X2(g)+Y2(g)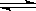 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是?(?? )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是?(?? )
A.Z为0.3mol/L
B.Y2为0.4mol/L
C.X2为0.2mol/L
D.Z为0.4mol/L
参考答案:A
本题解析:
试题分析:极端法求解。A.若反应物完全转化为生成物,则Z为0.4mol/L,但是可逆反应不能完全转化,因此Z小于0.4mol/L. Z为0.3mol/L是有可能的。正确。B.若Z完全转化为反应物,则Y2为0.4mol/L,但是可逆反应不能完全转化,因此Y2的平衡浓度小于0.4mol/L。错误。C. 若Z完全转化为反应物,则X2为0.2mol/L,但是可逆反应不能完全转化,因此X2的平衡浓度小于0.2mol/L。错误。D.若反应物完全转化为生成物,则Z为0.4mol/L,但是可逆反应不能完全转化,因此Z的平衡浓度小于0.4mol/L。错误。
本题难度:一般
5、计算题 (1)在一定温度下,向一个容积不变的容器中,通入2molN2和8molH2及固体催化剂,使之反应。已知:N2(g)+3H2(g) 2NH3(g);△H=-92.2kJ·mol-1。平衡时容器内气体压强为起始时的80%。(写出计算过程)
2NH3(g);△H=-92.2kJ·mol-1。平衡时容器内气体压强为起始时的80%。(写出计算过程)
①平衡时N2的物质的量????????, H2的转化率????????
②达到平衡时,放出的热量为????????????。
(2)在一个容积为500 mL的密闭容器中,充入5 mol H2和2 mol CO。在一定温度和一定压强下,发生如下反应:2H2(g)+CO(g)  ?CH3OH(g),经过5 min后达到平衡状态。若此时测得CH3OH蒸气的浓度为2 mol/L,求:(写出计算过程)
?CH3OH(g),经过5 min后达到平衡状态。若此时测得CH3OH蒸气的浓度为2 mol/L,求:(写出计算过程)
①以H2的浓度变化表示的该反应的速率
②达平衡时CO的转化率
③该温度下的K
参考答案:(1)①1摩尔
②37.5%
③92.2kJ<
本题解析:
试题分析:解:(1)设反应掉的氮气的物质的量为x,即
N2(g)??? +3H2(g)??? ??????2NH3(g)
??????2NH3(g)
起始的物质的量(mol)? 2???????? 8?????????????????????? 0
转化的物质的量(mol)? x???????? 3x????????????????????? 2x
平衡的物质的量(mol)2-x??????? 8-3x???????????????????? 2x
根据PV=nRT,所以(10-2x)/10=80%,所以x为1mol,
所以平衡时N2的物质的量为2-1=1mol,
H2的转化率=3x/8=3*1/8*100%=37.5%
达到平衡时,放出的热量=1*92.2kJ=92.2kJ
(2)设反应掉的氢气的物质的量为x,即
2H2(g)?+?? CO(g) ??? ????CH3OH(g)
????CH3OH(g)
起始的物质的量(mol)???? 5??????????2????????????????????? 0
转化的物质的量(mol)???? x???????? 0.5x???????????????????? 0.5x
平衡的物质的量(mol)???5-x??????? 2-0.5x??????????????????? 0.5x
有因为CH3OH蒸气的浓度为2 mol/L,所以0.5x=2×0.5,所以x=2mol,
所以以H2的浓度变化表示的反应速率v(H2)="2/0.5/5=0.8" mol/(L·min),
达平衡时CO的转化率=1/2×100%=50%,
K=c(CH3OH)/c2(H2)c(CO)=2/(6*6*2)=0.028。
点评:本题综合考查了化学反应,平衡常数的相关计算,有一定的综合性,考查的知识点比较全面,是一道不错的计算题
本题难度:一般