微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)【化学—化学与技术】
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。

(1)工业上采用电解氧化铝和冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝:2Al2O3 4Al+3O2↑。
4Al+3O2↑。
加入冰晶石的作用为_______________________。
(2)上述工艺所得铝材中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为________,下列可作阴极材料的是______。
a.铝材 b.石墨 c.铅板 d.纯铝
(3)阳极氧化能使金属表面生成致密的氧化膜。以稀硫酸为电解液,铝阳极发生的电极反应式_______________________。在铝阳极氧化过程中,需要不断地调整电压,理由是_________________。
(4)下列说法正确的是__________________。
a.阳极氧化是应用原电池原理进行金属材料表面处理的技术
b.铝的阳极氧化可增强铝表面的绝缘性能
c.铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
d.铝的阳极氧化膜富多孔性,具有很强的吸附性能,能吸附染料而呈各种颜色
参考答案:(1)主要是降低Al2O3的熔化温度 (2分) (
本题解析:
试题分析:(1)Al2O3的熔点较高,为了降低能耗加入冰晶石作助熔剂,所以冰晶石的主要作用是降低Al2O3的熔化温度。(2)阳极发生氧化反应,活泼的金属先放电,Al 较活泼所以Al 先放电,电极反应为:Al-3e-=Al3+,由于该工艺是提纯Al,所以为了减少杂质物质阴极用纯铝,选d。(3)根据信息“阳极氧化能使金属表面生成致密的氧化膜”知道是Al 反应生成了Al2O3,则电极反应为:2Al -6e-+3H2O
本题难度:困难
2、选择题 下列关于电解精炼铜的叙述中不正确的是
A.粗铜板为阳极
B.粗铜所含Au、Ag、Fe、Zn等杂质,电解后以单质形式沉积槽底,形成阳极泥
C.电解时,阳极发生氧化反应,而阴极发生的反应为Cu2++2e-=Cu
D.精铜的纯度可达99.95%~99.98%
参考答案:B
本题解析:
试题分析:A、精炼铜时,粗铜失电子,根据电解池工作原理,粗铜作阳极,精铜作阴极,说法正确;B、根据电解池工作原理,活动性金属作阳极,按照活动性强弱失电子,锌先失电子,然后是铁失电子,最后是铜失电子,金、银不参加反应,以单质形式沉积槽底,形成阳泥,错误;C、电解时,粗铜作阳极,反应式:Cu-2e-=Cu2+,化合价升高,发生氧化反应,阴极:Cu2++2e-=Cu,正确;D、精炼铜提高铜的纯度,纯度可达99.95%~99.98%,正确。
考点:考查精炼铜。
本题难度:一般
3、填空题 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:
CO(g)+2H2(g)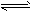 CH3OH(g)。
CH3OH(g)。
(1)分析该反应并回答下列问题:
①平衡常数表达式为K=____________。
②下列各项中,不能够说明该反应已达到平衡的是___________(填序号)。
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定条件下,CO、H2和CH3CH的浓度保持不变
d.一定条件下,单位时间内消耗2 mol CO,同时生成1 mol CH3OH
(2)下图是该反应在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变△H____0(填“>” “<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_______K2(填“>”“<”或“=”)。
③若容器容积不变,下列措施可增加甲醇产率的是________。
a.升高温度
b.将CH3OH(g)从体系中分离
c.使用合适的催化剂
d.充入He,使体系总压强增大
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H= -a kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H=-b kJ/mol
③H2O(g)=H2O(l) △H=-c kJ/mol
则:CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=____kJ/mol
(4)2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示。
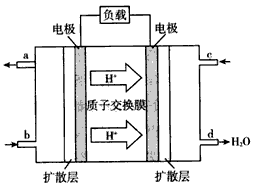
①该电池工作时,b口通入的物质为____,c口通入的物质为_______________
②该电池正极的电极反应式为:_________________。
③工作一段时间后,当6.4 g甲醇完全反应生成CO2时,有____NA个电子转移。
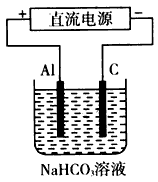
(5)以上述电池做电源,用下图所示装置,在实验室中模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示):________________
参考答案:(1)①![]() 本题解析:
本题解析:
本题难度:困难
4、选择题 用惰性电极电解Fe2(SO4)3和CuSO4的混合溶液,下列说法正确的是[???? ]
A.阴极反应式为:Cu2++2e-==Cu,当有Cu2+存在时,Fe3+不放电
B.阴极上首先析出铁,然后析出铜
C.阴极先是Fe3+放电,后Cu2+放电
D.阴极上不可能析出铜
参考答案:C
本题解析:
本题难度:一般
5、推断题 已知下图中物质M是由同一短周期的两种元素组成的离子化合物,焰色反应为黄色,阴离子元素最高正价与它的负价代数和为6。X具有漂白性,Y为碱性气体, W是对空气无污染的气体。试回答下列问题:

(1)写出电解M溶液①的化学方程式 。
(2)写出实验室制取Y气体的化学方程式 。
(3)若A是一种常见金属,写出反应②的化学方程式 。
(4)若A是某元素的一种常见酸性氧化物,写出反应③的离子方程式 。
(5)写出X的电子式 和Z的结构式 。
(6)写出反应⑤的化学方程式 。
(7)标准状况下反应⑥中生成11.2L W时转移的电子数 。(用NA表示阿佛加德罗常数)
参考答案:(1)2NaCl + 2H2O  本题解析:
本题解析:
试题分析:M是由同一短周期的两种元素组成的离子化合物,焰色反应为黄色,说明M中含有钠离子,阴离子元素最高正价与它的负价代数和为6,则该元素的最高价为+7价,负价为-1价,则该阴离子对应的元素是第七主族元素;X具有漂白性,可以判断M是NaCl,B是NaOH,C是氢气,D是氯气,F是HCl,氢氧化钠溶液与氯气反应生成次氯酸钠具有漂白性,所以X是次氯酸钠;Y为碱性气体,则Y是氨气, W是对空气无污染的气体,根据元素守恒判断W是氮气。
(1)电解食盐水的化学方程式2NaCl + 2H2O  2NaOH + H2↑+ Cl2↑;
2NaOH + H2↑+ Cl2↑;
(2)实验室用氯化铵与氢氧化钙加热制取氨气,化学方程式为
2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(3)与氢氧化钠反应的金属是Al,则Al与氢氧化钠溶液反应生成偏铝酸钠和氢气,离子方程式为2Al+2OH-+2H2O==2AlO-+3H2↑;
(4)A是某元素的一种常见酸性氧化物,与氢氧化钠溶液反应的酸性氧化物是二氧化硅,二者反应生成硅酸钠、水,则盐酸与硅酸钠反应生成硅酸沉淀,离子方程式为SiO32-+2H+==H2SiO3↓;
(5)次氯酸钠与氨气反应生成氯化钠和Z,Z与二氧化氮反应生成氮气和水,所以Z在含有H元素,二氧化氮中N的化合价是+4价,则Z中含有N元素且化合价低于0价,所以Z是N2H4,次氯酸钠是离子化合物,电子式为 ,N2H4的结构式为
,N2H4的结构式为 ;
;
(6)根据以上分析,次氯酸钠与氨气反应的化学方程式为NaClO +2NH3==NaCl+N2H4+H2O;
(7)反应⑥为2N2H4+2NO2=3N2+4H2O,标准状况下生成11.2L氮气,物质的量是0.5mol时,消耗二氧化氮的物质的量是1/3mol,所以转移电子的物质的量是1/3mol×4=4/3mol,电子数是4/3NA。
考点:考查物质的推断,涉及电解原理,物质的化学性质,电子式、结构式的书写,离子方程式、化学方程式的书写
本题难度:困难