微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定条件下,在2L的密闭容器中通入4.0mol的N2和适量的H2,发生反应:N2(g)+3H2(g)?2NH3(g).经过5s后,测得N2剩余2.0mol,在这5s内N2的反应速率为( )
A.0.2molL-1s-1
B.0.3molL-1s-1
C.0.4molL-1s-1
D.0.5molL-1s-1
参考答案:经过5s后,测得N2剩余2.0mol,氮气的浓度变化量为
本题解析:
本题难度:一般
2、简答题 (本题共12分)
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
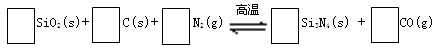
29.配平反应中各物质的化学计量数,并标明电子转移方向和数目。
30.该反应的氧化剂是???????????????,其还原产物是??????????????。
31.上述反应进程中能量变化示意图如下,试在图像中用虚线表示在反应中使用催化剂后能量的变化情况。
 ???????????
???????????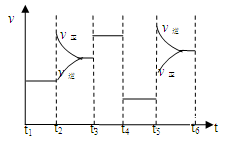
32.该反应的平衡常数表达式为K=??????????????。升高温度,其平衡常数??????(选填“增大”、“减小”或“不变”)。
33.该化学反应速率与反应时间的关系如上图所示,t2时引起v正突变、v逆 渐变的原因是??
????????????????,t3引起变化的因素为?????????????????????????,t5时引起v逆大变化、v正小变化的原因是???????????????????????????????????。
参考答案:
 本题解析:
本题解析:
试题分析:30、该反应中碳化合价由0价到+2,氮元素由0价变为-3价,氮气为氧化剂,氮化硅为还原产物;31、催化剂不改变反应能量变化但可以降低反应活化能,即起点、终点与原图像一致,波峰的高度比原图像低;32、由图确定该反应为放热反应,升高温度平衡逆向移动,平衡常数变小;33、t2时图像逆反应速率没变,正反应速率增大应为增加气态反应物浓度,t3时反应速率增大,平衡不移动,(而且方程式化学计量数不等不是压强改变)应该是使用正催化剂;t5时反应速率均增大,且逆反应速率大于正反应速率,应为升高温度或缩小容器体积增大压强。
本题难度:一般
3、填空题 (11分)在一定温度下将2 mol A和2 mol B两种气体混合于某2L密闭容器中,发生如下反应: 3A(g)+B(g)
3A(g)+B(g)  2C(g)+2D(g),2 min末反应达到平衡状态,生成了0.8 mol D,请填写下列空白:
2C(g)+2D(g),2 min末反应达到平衡状态,生成了0.8 mol D,请填写下列空白:
(1)2min内B的反应速率为_________________
(2)此温度下该反应的平衡常数K=_________________________
(3)如果缩小反应容器的体积,使压强增大,平衡体系中C的物质的量浓度_____________,C的质量分数___________,容器内气体的平均密度________________,平均相对分子质量________________。(填“增大”、“减小”或“不变”)
(4)如果上述反应在相同条件下从逆反应开始进行,开始加C和D各4/3 mol,要使平衡时各物质的物质的量与原平衡相等,则还应加入__________物质___________mol。
参考答案:(11分)
(1)0.1moL/(L·min)?(2分
本题解析:(1)根据速率公式可计算出用D表示的反应速率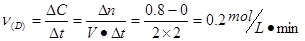 ,同一反应中,速率之比等于反应方程式的计量数之比,所以
,同一反应中,速率之比等于反应方程式的计量数之比,所以
(2)反应到达平衡时各物质的物质的量变化如下:

平衡时各物质的浓度分别为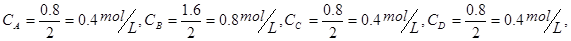
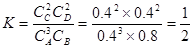
(3)若果缩小容器的体积,增大压强,根据反应前后气体体积不变,所以增大压强,平衡不发生移动,C的物质的量不变,体积变小,C的物质的量浓度增大;因为平衡不移动所以C得质量分数不变;气体的总质量不变,但是气体的体积减小,所以混合气体的平均密度增大;平均相对分子质量计算公式为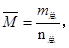 反应前后都是气体,根据质量守恒,总质量不变,反应前后体积没有发生变化,所以反应前后总的物质的量也不发生变化,根据公式可判断平局相对分子质量也不变。
反应前后都是气体,根据质量守恒,总质量不变,反应前后体积没有发生变化,所以反应前后总的物质的量也不发生变化,根据公式可判断平局相对分子质量也不变。
(4)要使与原平衡相同,即是达到等效平衡,若将4/3 mol的 C和D转化为反应物A和B,根据方程式可得到A为2mol与原平衡的投料相同, B为 mol,原平衡中B的量为2mol,要使原平衡相同必须再加入B物质2—
mol,原平衡中B的量为2mol,要使原平衡相同必须再加入B物质2— =
=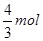 。
。
本题难度:一般
4、选择题 在2A+B 3C+5D反应中,表示该反应速率最快的是 [???? ]
3C+5D反应中,表示该反应速率最快的是 [???? ]
A.υ(A)= 0.5 mol/(L·s)
B.υ(B)= 0.3 mol/(L·s)
C.υ(C)= 0.8 mol/(L·s)
D.υ(D)= 1 mol/(L·s)
参考答案:B
本题解析:
本题难度:简单
5、选择题 如图表示外界条件(温度、压力)的变化对下列反应的影响:L(s)+G(g) 2R(g)?ΔH>0。在图中Y轴是指
2R(g)?ΔH>0。在图中Y轴是指

A.平衡混合气中R的质量分数
B.G的转化率
C.平衡混合气中G的体积分数
D.L的转化率
参考答案:C
本题解析:
试题分析:A、升温,平衡正向移动,R的质量分数增大,与图像不符,故A错误;B、升温,平衡正向移动,G的转化率增大,与图像不符,故B错误;C、升温,平衡正向移动,平衡混合气中G的体积分数减小;增大压强,平衡逆向移动,G的体积分数增大,与图像一致,故C正确;D、温度升高,平衡正向移动,L的转化率增大,与图像不符,故D错误。
本题难度:一般