微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu( 91EXAm.orgNO3)2,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性。金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
A.Cu与Cu2O的物质的量之比为2∶1
B.硝酸的物质的量浓度为2.6mol/L
C.产生的NO在标准状况下的体积为4.48L
D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
2、填空题 欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
__C+__K2Cr2O7+__ →__CO2↑+ __K2SO4 + __Cr2(SO4)3+__H2O
请完成并配平上述化学方程式。
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+ 2H2(g) CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
①下列措施中有利于增大该反应的反应速率的是 _______;
A.随时将CH3OH与反应混合物分离
B.降低反应温度
C.增大体系压强
D.使用高效催化剂
②已知: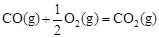 △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1
 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程式为 ;
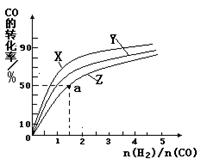
③在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。请回答:
3、选择题 在反应5NH4NO3 ="=" 2HNO3 + 4N2 + 9H2O中,发生氧化反应与发生还原反应的氮原子个数之比是
A.2:8
B.5:3
C.5:8
D.5:4
4、填空题 某化学兴趣小组用以下装置探究SO2的某些化学性质。
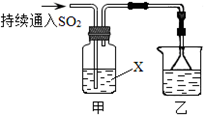
(1)装置乙的作用是?????????????????????????。
(2)若X为品红溶液,观察到溶液褪色,说明SO2具有???????????????(填序号,下同);若X为Na2S溶液,观察到溶液中出现淡黄色浑浊,说明SO2具有?????????????。
a.氧化性???????????? b.还原性???????????? c.漂白性
(3)若试剂X为Ca(ClO)2溶液,可观察到白色沉淀生成,完成该过程的离子方程式:
 Ca2++
Ca2++ ClO-+
ClO-+ SO2+
SO2+ H2O=
H2O= ?????↓+
?????↓+ Cl-+
Cl-+ SO42-+
SO42-+ ????。
????。
5、简答题 钛(Ti)具有高强度和耐酸腐蚀性,是重要的工业原料.以金红石(主要成分为TiO2,含少量Fe2O3、SiO2)为原料可制取Ti.工业流程如下:
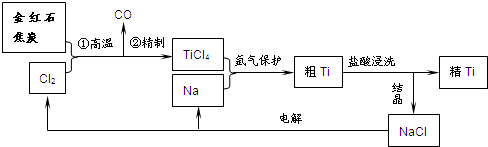
(1)粗TiCl4中含有少量FeCl3、SiCl4等,它们的部分性质如下:
| 物质 | 沸点/°C | 在水中 | ?在乙醚中
?TiCl4
??136
强烈水解
??易溶
?SiCl4
??58
?强烈水解
??易溶
?FeCl3
??303(升华)
水解
??易溶
从粗TiCl4中精制TiCl4的方法是______???A.用水溶解后,重结晶???B.蒸馏???C.用乙醚萃取后,分液
(2)写出金红石高温反应制取TiCl4的化学方程式______.
(3)写出电解熔融NaCl的化学方程式______;阴极产物是______.
(4)粗钛产品粉碎后要用盐酸浸洗.其主要目的是______.
(5)Ti可溶解在浓HF溶液中,请完成下列离子方程式.______Ti+______HF-______TiF62-+______+______H2↑
|