3~4
?
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不科学的是??
A.向该溶液中加少量铁粉不能观察到红色固体析出
B.该溶液中c(SO42-):[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5:4
C.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
D.向该溶液中加入适量氯水,并调节pH值到3~4后过滤,得到纯净的CuSO4溶液
参考答案:D
本题解析:
试题分析:A.因为Fe3+的氧化性强于Cu2+,所以投入少量铁粉,先发生的反应是:2Fe3++Fe=3Fe2+,不能观察到红色固体析出,正确; B.因为Cu2+、Fe2+、Fe3+对应的碱全是弱碱,所以这三种离子在溶液中都会发生水解,因此它们的物质的量会减少,正确; C.从表格中可以看出,Fe(OH)3的Ksp是最小的,所以它最先出现沉淀,正确; D.加入氯水,可以把亚铁离子全氧化成三价,但它的还原产物Cl-肯定还在溶液中,而且在调节pH时加入的试剂也会在溶液中有所保留,所以得到的溶液中不可能只含
本题难度:一般
2、选择题 (3分)下列说法不正确的是__________。
A.物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的;
B.对于Al(OH)3(s)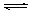 Al(OH)3(aq) Al(OH)3(aq) 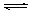 Al3++3OH-,前者为溶解平衡,后者为电离平衡; Al3++3OH-,前者为溶解平衡,后者为电离平衡;
C.除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3大
D.沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全。
参考答案:(3分)? A C
本题解析:A错,如氢氧化钠溶解会放出热量;B正确,Al(OH)3(s)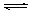 Al(OH)3(aq) Al(OH)3(aq) 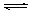 ?Al3++3OH-,前者为溶 ?Al3++3OH-,前者为溶
本题难度:一般
3、选择题 已知锌及其化合物的性质与铝及其化合物相似。如图,横坐标为溶液的pH,纵坐标为Zn2+离子或[Zn(OH)4]2-离子的物质的量浓度(假设Zn2+离子浓度为10-5mol·L-1时,Zn2+离子已沉淀完全)。下列说法不正确的是????
 [???? ] [???? ]
A.往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为: Zn2++4OH-=[Zn(OH)4]2-
B.从图中数据计算可得Zn(OH)2的溶度积Ksp=10-17 mol3·L-3
C.某废液中含Zn2+离子,沉淀Zn2+离子可以控制溶液pH的范围是8~12
D.向1L1?mol·L-1 ZnCl2溶液中加入NaOH固体至pH=7,需NaOH?2mol
参考答案:D
本题解析:
本题难度:一般
4、填空题 某课外兴趣小组为了探究碱性溶液中Mg2+、AlO2-与溶液pH的关系,进行下列实验:向含有0.1mol
HCl、0.1mol MgCl2、1.0mol AlCl3的混合溶液中逐渐加入NaOH溶液,均至反应后溶液体积1L。测得部分实验数据如下表

试回答:
(1)向混合溶液中加入NaOH溶液至pH=9,能否有Mg(OH)2沉淀出现__________(填“能”或“否”),由此你得到的初步结论是_______________________________。
(2)向混合溶液中加入NaOH溶液至pH=10,需要NaOH溶液中有多少克NaOH?(最后结果保留两位小数)
参考答案:(1)否;Mg2+在弱碱性溶液中不能生成沉淀或Mg(OH)2
本题解析:
本题难度:困难
5、选择题 氢氧化镁固体在水中达到溶解平衡Mg(OH)2(s) Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2固体的量减少,可加入少量的(???) Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2固体的量减少,可加入少量的(???)
A.NaOH
B.NH4Cl
C.MgSO4
D.NaHSO4
参考答案:BD
本题解析:Mg(OH)2(s) Mg2+(aq)+2OH-(aq),加入氯化铵,铵根和氢氧根结合生成一水合氨,氢氧根减少,平衡正向移动;硫酸氢钠消耗氢氧根,平衡正向移动,氢氧化镁量减少; Mg2+(aq)+2OH-(aq),加入氯化铵,铵根和氢氧根结合生成一水合氨,氢氧根减少,平衡正向移动;硫酸氢钠消耗氢氧根,平衡正向移动,氢氧化镁量减少;
本题难度:一般
|