微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列热化学方程式或离子方程式中,正确的是[???? ]
A.甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热
19.3kJ,其热化学方程式为: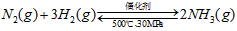 ?△H=-38.6kJ·mol-1
?△H=-38.6kJ·mol-1
C.氯化镁溶液与氨水反应: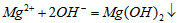
D.氧化铝溶于NaOH溶液:Al2O3 + 2OH- =2AlO2- + H2O
参考答案:D
本题解析:
本题难度:一般
2、选择题 0.5mol氢气和0.5mol碘晶体完全反应,生成1mol碘化氢气体,吸收26.5kJ的热,则下列热化学方程式正确的是( ? )
A.H2(g)+I2(s)→2HI(g)-26.5kJ
B.H2+I2→2HI-53kJ
C.H2(g)+I2(s)→2HI(g)-53kJ
D.0.5H2+0.5I2→HI-26.5kJ
参考答案:C
本题解析:
本题难度:一般
3、选择题 下列各组热化学方程式中,化学反应的△H前者大于后者的是( )
①C(g)+O2(g?)═CO2(g),△H1;????? ?C(g)+
1
2
O2(g)═CO(g?),△H2;
②S(s)+O2(g?)═SO2(g),△H3;????? ?S(g)+O2(g)═SO2(g),△H4;
③H2(g)+1
2
O2(g?)═H2O(l),△H5;?? ?2H2(g)+O2(g)═2H2O(l),△H6;
④CaCO3(s)═CaO(s)+CO2(g),△H7;?? CaO(s)+H2O?(l)═Ca(OH)2(s),△H8.
A.①②③
B.②③④
C.④
D.①
参考答案:B
本题解析:
本题难度:简单
4、填空题 研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s) + 3C(石墨) =" 2Fe(s)" + 3CO(g) △H 1 =" +489.0" kJ·mol-1
C(石墨) +CO2(g) = 2CO(g) △H 2 =" +172.5" kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K= 。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图A所示,则该反应的ΔH 0(填“>”、“<”或“=”)。

③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图B所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>” 或“<”)。
(3)以CO2为原料还可以合成多种物质。①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为 。当氨碳比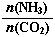 =3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为 。 =3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为 。
②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为 。
参考答案:(1)Fe2O3(s)+3CO(g) = 2Fe(s)+3C
本题解析:
试题分析:(1)根据已知方程式和盖斯定律,所求方程式可由①-②×3得,△H = △H 1-3△H 2 =" +489.0" kJ·mol-1-3×172.5 kJ·mol-1 =—28.5 kJ·mol-1 ,所以CO还原氧化铁的热化学方程式为:Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) △H = —28.5 kJ·mol-1 。
(2)①根据给出的热化学方程式可得出该反应的平衡常数表达式为:K= 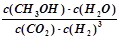 , ,
②图A中生成物甲醇的体积分数随着温度升高呈现出先增大后减小的变化,可以分析为达到最高点之前反应并未达到平衡,随温度升高反应速率加快,甲醇含量不断增大;当达到一定值时,反应达到平衡,此时再升高温度平衡发生移动,甲醇含量下降可以看出平衡逆向移动,所以该反应正反应为放热反应,ΔH<0。
③图B中不同条件下反应达到平衡时得到的甲醇的物质的量I>Ⅱ,所以I条件下的反应进行程度更大,所以KⅠ>KⅡ 。
(3)①工业用CO2和NH3在一定条件下合成尿素,该反应方程式可以由C:N比进行配平,所以方程式为: 2NH3+CO2 CO(NH2)2+H2O;根据方程式中的系数可知,反应的n(NH3)=2n(CO2),而总的n(NH3)=3n(CO2),所以假设的CO2有1mol,则有n(NH3)=3n(CO2)=3mol,反应的n(NH3)=2×1×0.6 =1.2mol所以氨气的平衡转化率为40%。 CO(NH2)2+H2O;根据方程式中的系数可知,反应的n(NH3)=2n(CO2),而总的n(NH3)=3n(CO2),所以假设的CO2有1mol,则有n(NH3)=3n(CO2)=3mol,反应的n(NH3)=2×1×0.6 =1.2mol所以氨气的平衡转化率为40%。
②在酸性电介质中发生电解反应,考虑氢离子参加反应,CO2在电极上得电子被还原为甲烷,有水生成,所以电极反应式为:CO2+8e—+8H+=CH4+2H2O。
考点:本题考查的是化学反应原理的知识,主要涉及热化学方程式的书写、盖斯定律的应用、平衡常数的表达、焓变的大小判断、平衡图像的理解等知识。
本题难度:困难
5、选择题 已知1g火箭燃料肼(N2H4)气体燃烧生成N2和H2O(g)时,放出16.7kJ的热量,则该反应的热化学方程式正确的是( ? ) A.N2H4+O2=N2+2H2O△H=-534.4kJ/mol
B.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.4kJ/mol
C.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=+534.4kJ/mol
D.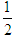 N2H4(g)+ N2H4(g)+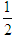 O2(g)= O2(g)= N2(g)+H2O(g)△H=-16.7kJ/mol N2(g)+H2O(g)△H=-16.7kJ/mol
参考答案:B
本题解析:
本题难度:一般
|
|
网站客服QQ: 960335752 - 14613519 - 791315772