微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (16分)碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液,生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g)+ CH3OCOOCH3(g) 2 CH3OCOOC2H5(g) ΔH1
2 CH3OCOOC2H5(g) ΔH1
(1)其他条件相同,CH3OCOOCH3的平衡转化率(α)与温度(T)、反应物配比(R)的关系如图所示。
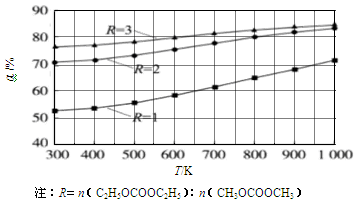
①ΔH1______0(填“<”、“=”或“>”)。
②由图可知,为了提高CH3OCOOCH3的平衡转化率,除了升温,另一措施是___________。
③在密闭容器中,将1mol C2H5OCOOC2H5和1mol CH3OCOOCH3混合加热到650K,利用图中的数据,求此温度下该反应的平衡常数K(请写出计算过程)。
(2)已知:CH3OCOOCH3(g) + C2H5OH(g) CH3OCOOC2H5(g) + CH3OH(g) ΔH2
CH3OCOOC2H5(g) + CH3OH(g) ΔH2
CH3OCOOC2H5(g) + C2H5OH(g) C2H5OCOOC2H5(g) + CH3OH(g) ΔH3
C2H5OCOOC2H5(g) + CH3OH(g) ΔH3
ΔH1=____________________(用ΔH2和ΔH3表示)
(3)已知上述反应需要催化剂,请在答题卡的坐标图中,画出有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注。
参考答案:(1)① >(2分)② 增大反应物中C2H5OCOOC2H5
本题解析:
试题分析:(1)①根据图像变化可知,在反应物配比相同的条件下,温度越高,CH3OCOOCH3的平衡转化率越大,这说明升高温度平衡向正反应方向进行,因此该反应的正反应为吸热反应,即△H>0;
②根据图像变化可知,在温度相同的条件下,R越大,CH3OCOOCH3的平衡转化率越大,因此除升温外,还可增大反应物中C2H5OCOOC2H5的浓度(或比例);
③由图知,R=1,650K,达到平衡时CH3OCOOCH3的转化率为60%。设容器的容积为V(L),则
C2H5OCOOC2H5(g)+ CH3OCOOCH3(g) 2CH3OCOOC2H5(g)
2CH3OCOOC2H5(g)
初始浓度/ mol·L-1: 1/V 1/V 0
平衡浓度/ mol·L-1: 0.4/V 0.4/V 1.2/V
所以该温度下平衡常数K=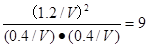
(2)已知①CH3OCOOCH3(g)+C2H5OH(g) CH3OCOOC2H5(g)+CH3OH(g)△H2,②CH3OCOOC2H5(g)+C2H5OH(g)
CH3OCOOC2H5(g)+CH3OH(g)△H2,②CH3OCOOC2H5(g)+C2H5OH(g) C2H5OCOOC2H5(g)+CH3OH(g)△H3,则根据盖斯定律可知,①-②可得C2H5OCOOC2H5(g)+CH3OCOOCH3(g)
C2H5OCOOC2H5(g)+CH3OH(g)△H3,则根据盖斯定律可知,①-②可得C2H5OCOOC2H5(g)+CH3OCOOCH3(g) 2CH3OCOOC2H5(g),所以反应热△H1=△H2-△H3;
2CH3OCOOC2H5(g),所以反应热△H1=△H2-△H3;
(3)催化剂不影响平衡状态和反应热,但催化剂降低反应所需的活化能,即可反应速率,因此有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图可表示为
 。
。
考点:考查外界条件对平衡状态的影响、化学平衡图像分析以及平衡状态和反应热的有关计算等
本题难度:困难
2、选择题 下列依据热化学方程式得出的结论正确的是 [???? ]
A.已知2H2(g)+O2(g)=2H2O(l) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为483.6 kJ·mol-1
B.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C.已知2C(s)+2O2(g)=2CO2(g) ΔH1 2C(s)+O2(g)=2CO(g) ΔH2 则ΔH1>ΔH2
D.已知Ni(CO)4(s)=Ni(s)+4CO(g) ΔH=Q kJ·mol-1,则Ni(s)+4CO(g)=Ni(CO)4(s) ΔH=-Q kJ·mol-1
参考答案:D
本题解析:
本题难度:一般
3、填空题 (7分) 研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)这三种氧化物中,属于酸性氧化物的是____________(用化学式表示)。
(2)NO2可用水吸收,相应的化学反应方程式为 。利用反应6NO2+8NH  7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
(3)已知:2SO2(g)+O2(g) 2SO3(g) ΔH1= - 196.6 kJ·mol-1
2SO3(g) ΔH1= - 196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH2= - 113.0 kJ·mol-1
2NO2(g) ΔH2= - 113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的 ΔH3= kJ·mol-1。
SO3(g)+NO(g)的 ΔH3= kJ·mol-1。
参考答案:(共7分)
(1)SO2(1分)
(2)3NO2
本题解析:
试题分析:(1)能与碱反应生成盐和水的氧化物是酸性氧化物,这三种氧化物中,只有SO2属于酸性氧化物。
(2)NO2与H2O反应生成HNO3和NO,化学方程式为:3NO2+H2O=2HNO3+NO;反应6NO2+8NH3 7N2+12H2O中,6NO2中N元素化合价降低,由+4价降低到0价,则6molNO2参加反应,转移24mol电子,所以当转移1.2mol电子时,消耗NO20.3mol,标准状况下体积为6.72L。
7N2+12H2O中,6NO2中N元素化合价降低,由+4价降低到0价,则6molNO2参加反应,转移24mol电子,所以当转移1.2mol电子时,消耗NO20.3mol,标准状况下体积为6.72L。
(3)已知:①2SO2(g)+O2(g)?2SO3(g)△H1= -196.6kJ?mol-1
②2NO(g)+O2(g)?2NO2(g)△H2= -113.0kJ?mol-1,利用盖斯定律将①×1/2-②×1/2得NO2(g)+SO2(g)?SO3(g)+NO(g)△H3=1/2×(-196.6kJ?mol-1)- 1/2×(-113.0kJ?mol-1)= -41.8kJ?mol-1。
考点:本题考查酸性氧化物的判断、化学方程式的书写、氧化还原反应的计算、热化学方程式的书写。
本题难度:一般
4、简答题 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是:______;
(2)PCl5分解成PCl3和Cl2的热化学方程式是:______;
上述分解反应是一个可逆反应.温度T1时,在密闭容器中加入0.80mol?PCl5,反应达平衡时PCl5还剩0.60mol,其分解率α1等于______;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2______α1(填“大于”、“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,现将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5.原因是______;
(4)P和Cl2分两步反应生成1mol?PCl5的△H?3=______,P和Cl2一步反应生成1mol?PCl5的△H?4______△H?3(填“大于”、“小于”或“等于”).
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是:______.
参考答案:(1)热化学方程式书写要求:注明各物质的聚集状态,判断放热反
本题解析:
本题难度:一般
5、填空题 X、Y、Z、W、T是元素周期表中前四周期的五种元素。有关这五种元素的信息如下表:
元素代号
| 相关信息
|
X
| 它的一种核素的原子核内没有中子
|
Y
| 能组成很多种性质不同的单质,也是形成化合物种类最多的一种元素
|
Z
| 基态原子的最外层电子排布式为nsnnpn+1
|
W
| 与钠元素能组成两种化合物,这些化合物与水反应均生成碱;大气平流层中W3被誉为地球生物“保护伞”
|
T
| 主要化合价有+1和+2价,其二价离子在水溶液中呈蓝色
请推出具体元素,用化学用语回答下列问题:
(1)写出W元素在周期表中的位置____________。写出T元素的基态电子排布式________________。
(2)在这五种元素中电负性最大的是________,Y Z W三种元素的第一电离能顺序为_______________。
(3)由X Z 两种元素可以形成一种ZX5的既含离子键又含共价键的化合物,其电子式为__________。
(4)TW在高温条件下是一种优良的氧化剂,它能将很多有机化合物完全氧化(相当于完全燃烧),写出高温条件下,TW与Y最简单的氢化物反应的化学方程式:_______________________________________。
(5)已知在25℃、101 kPa下:
XYZ(aq)+X2W(1)  YZ- (aq)+X3W+(aq) ΔH="+45.6" KJ/mol YZ- (aq)+X3W+(aq) ΔH="+45.6" KJ/mol
X3W+(aq)+WX(aq)=2X2W(1) ΔH="-57.3" KJ/mol
则在25℃、101 kPa的稀溶液中,XYZ与WX反应的热化学方程式(以离子方程式表示) :_________。
参考答案:(1)第二周期第ⅥA , 1S2 2S2 2P6 3S2 3
本题解析:
试题分析:根据题目提供的信息可知:X是H;Y是C;Z是N;W是O;T是Cu。(1)O元素在周期表中的位置是位于第二周期第ⅥA。29号元素是Cu。由于原子核外的电子在各个轨道上排布处于半充满、全充满或全空时是稳定的状态。所以Cu的基态电子排布式1S2 2S2 2P6 3S2 3P6 3d104s1。(2)元素的非金属性越强,其电负性最大。在这五种元素中非金属性最强的是O元素。所以电负性最大的是O。一般情况下,同一周期的元素,元素的原子半径越小,元素失去电子就越难,电离能就越大。但当原子核外的电子在各个轨道上排布处于半充满、全充满或全空时是稳定的状态。C、N、O三种元素的第一电离能顺序为N >O >C。(3)离子化合物NH5的电子式为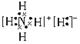 。(4)高温条件下,TW与Y最简单的氢化物反应的化学方程式:CH4+4CuO 。(4)高温条件下,TW与Y最简单的氢化物反应的化学方程式:CH4+4CuO  4Cu+CO2+2H2O。(5)将①+②,整理可得HCN(aq)+OH-(aq) =CN-(aq)+H2O(1) ΔH="-11.7" kJ/mol。 4Cu+CO2+2H2O。(5)将①+②,整理可得HCN(aq)+OH-(aq) =CN-(aq)+H2O(1) ΔH="-11.7" kJ/mol。
考点:考查元素的推断、原子的电子排布式、元素的位置、电子式的书写、电负性的比较、化学方程式、热化学方程式的书写的知识。
本题难度:困难
|