微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)已知:C3H8(g)+5O2(g) ===3CO2(g)+4H2O(1) △H=-2220.0kJ/mol
H2O(1) ===H2O(g);△H=+44.0kJ/mol
写出丙烷燃烧生成CO2和气态水的热化学方程式 。
(2)在如图所示的实验装置中,E为一张用淀粉碘化钾溶液润湿的滤纸,C、D为夹在滤纸两端的铂夹,X、Y分别为直流电源的两极。在A、B中充满AgNO3溶液后倒立于盛有AgNO3溶液的水槽中,再分别插入铂电极。切断电源开关S1,闭合开关S2,通直流电一段时间后,B电极质量增重,A极产生无色气体。请回答下列问题:
① 写出D电极反应式: ;
②写出水槽中电解AgNO3溶液总反应的离子方程式: ,阴极增重2.16 g,则阳极上放出的气体在标准状况下的体积是____ _L。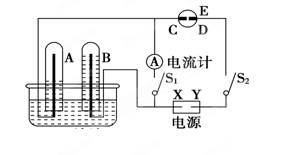
参考答案:(1)C3H8(g)+5O2(g)=3CO2(g)+4H2O
本题解析:
试题分析:(1)已知:①C3H8(g)+5O2(g) ===3CO2(g)+4H2O(1) △H=-2220.0kJ/mol、②H2O(1) ===H2O(g);△H=+44.0kJ/mol,则根据盖斯定律可知①+②×4即得到丙烷燃烧生成CO2和气态水的热化学方程式C3H8(g)+5O2(g)=3CO2(g)+4H2O(g),所以该反应的反应热△H=-2220.0kJ/mol+44.0kJ/mol×4=-2044kJ/mol。
(2)①切断电源开关S1,闭合开关S2,则构成电解池。通直流电一段时间后,B电极质量增重,这说明B电极是阴极,溶液中的金属阳离子放电析出金属。A极是阳极,溶液中的OH-放电产生无色气体氧气。所以Y电极是电源的负极,X是正极。则D电极是阴极,溶液中的碘离子放电生成单质碘,电极反应式为2I--2e-=I2。
②惰性电极电解硝酸银溶液生成硝酸、氧气和银,离子方程式为4Ag++2H2O 4Ag+4H++O2↑。阴极增重2.16 g,即银的质量是2.16g,物质的量是2.16g÷108g/mol=0.02mol。所以根据方程式可知,生成氧气的物质的量=0.02mol÷4=0.005mol。因此在标准状况下的体积=0.005mol×22.4L/mol=0.112L。
4Ag+4H++O2↑。阴极增重2.16 g,即银的质量是2.16g,物质的量是2.16g÷108g/mol=0.02mol。所以根据方程式可知,生成氧气的物质的量=0.02mol÷4=0.005mol。因此在标准状况下的体积=0.005mol×22.4L/mol=0.112L。
考点:考查盖斯定律的应用、电化学原理的应用、判断与计算
本题难度:困难
2、填空题 (14分)以煤为主要原料可以制备乙二醇,相关工艺流程如下:
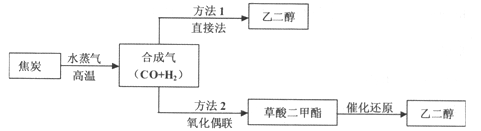
(1)写出方法l在催化剂的条件下直接制取乙二醇的化学方程式
(2)合成气在不同催化剂作用下,可以合成不同的物质。下列物质仅用合成气为原料就能得到且原子利用率为100%的是 (填字母)。
A.草酸( HOOC-COOH) B.甲醇(CH3OH) C.尿素[CO(NH2)2]
(3)工业上还可以利用天然气(主要成份为CH4)与C02反应制备合成气。已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ/mol
2H2(g)+ O2(g)= 2H2O(l) △H=-571.6kJ/mol
2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol
则CH4与CO2生成合成气的热化学方程式为 。
(4)方法2:在恒容密闭容器中投入草酸二甲酯和H2发生如下反应:
CH3OOC—COOCH3(g)+ 4H2(g) HOCH2CH2OH(g)+2CH3OH(g)△H=-34kJ/mol
HOCH2CH2OH(g)+2CH3OH(g)△H=-34kJ/mol
为提高乙二醇的产量和速率,宜采用的措施是___________(填字母)。
A.升高温度 B.增大压强 C.增大氢气浓度
(5)草酸二甲酯水解生成草酸:CH3OOC—COOCH3+ 2H2O HOOC—COOH+2CH3OH
HOOC—COOH+2CH3OH
①草酸是二元弱酸,可以制备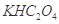 (草酸氢钾),
(草酸氢钾), 溶液呈酸性,用化学平衡原理解释: 。
溶液呈酸性,用化学平衡原理解释: 。
②在一定的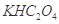 溶液中滴加NaOH溶液至中性。下列关系一定不正确的是 (填字母)。
溶液中滴加NaOH溶液至中性。下列关系一定不正确的是 (填字母)。
A.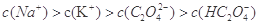
B.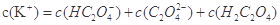
C.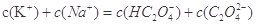
(6)乙二醇、空气在KOH溶液中构成燃料电池,加入乙二醇的电极为电源的 (填“正”或“负”)级,负极反应式为 。
参考答案:(1)2CO+3H2 本题解析:
本题解析:
试题分析:(1)CO与氢气在催化剂条件下生成乙二醇,化学方程式为2CO+3H2 HOCH2CH2OH;
HOCH2CH2OH;
(2)根据元素守恒定律,仅用CO和氢气为原料,无法合成草酸和尿素,只能合成甲醇,且原料气全部转化为甲醇,原子的利用率100%,答案选B;
(3)根据盖斯定律,将第一个热化学方程式减去第二和第三个热化学方程式的和可得所求的热化学方程式,所以甲烷与二氧化碳反应制取CO和氢气的热化学方程式是CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=(-890.3)kJ/mol-(-571.6-566.0)kJ/mol=+247.3kJ/mol;
(4)A.升高温度,则平衡逆向移动,反应速率加快,但产率降低,错误; B.增大压强,平衡正向移动,乙二醇的产率增大,反应速率加快,正确;C.增大氢气浓度,则平衡正向移动,乙二醇的产率增大,反应物浓度增大,反应速率加快,正确,答案选BC;
(5)①草酸是二元弱酸,草酸氢钾溶液呈酸性,溶液中存在HC2O4-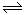 H++ C2O42-, HC2O4-+H2O
H++ C2O42-, HC2O4-+H2O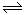 H2C2O4+OH-,因为草酸氢根离子的电离程度大于其水解程度,所以溶液呈酸性;
H2C2O4+OH-,因为草酸氢根离子的电离程度大于其水解程度,所以溶液呈酸性;
②A、若钠离子浓度大于钾离子浓度,则氢氧化钠的物质的量大于草酸氢钾的物质的量,则溶液呈碱性,错误;B、根据草酸氢钾的化学式,则符合物料守恒,正确;C、中性溶液中c(OH-)= c(H+),结合电荷守恒定律,则c(Na+)+ c(K+)= c(HC2O4-)+ 2c(C2O42-),错误,答案选AC;
(6)乙二醇、空气在KOH溶液中构成燃料电池,加入乙二醇的电极发生氧化反应,所以作电源的负极;乙二醇失去电子,与氢氧根离子结合为碳酸根离子和水,电极反应式为HOCH2CH2OH-10e-+14OH-=2CO32-+10H2O。
考点:考查盖斯定律的应用,溶液中离子浓度的比较,溶液酸碱性的判断,化学平衡移动的判断
本题难度:困难
3、填空题 (1)8g液态的CH3OH在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出Q kJ的热量。试写出液态CH3OH燃烧热的热化学方程式 。
(2)在化学反应过程中,破坏旧化学键需要吸收能量,形成新化学键又会释放能量。
化学键
| H—H
| N—H
| N≡N
|
键能/kJ·mol-1
| 436
| 391
| 945
已知反应N2+3H2=2NH3 ΔH=a KJ/mol。
试根据表中所列键能数据计算a的数值为: 。
(3)已知:C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ/mol
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599 kJ/mol
根据盖斯定律,由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的热化学方程式: 。
参考答案:.(1)CH3OH(l)+3/2 O2(g)= CO2(g)
本题解析:
试题解析:(1) 燃烧热是1 mol可燃物完全燃烧生成稳定氧化物释放的热量。8g CH3OH燃烧放热Q kJ,则1 molCH3OH完全燃烧放热4Q kJ.所以CH3OH(l)+ O2(g)= CO2(g)+2H2O(l) ΔH=-4QKJ/mol;(2) ΔH=反应物的键能总和-生成物的键能总和=(945+3×436)kJ/mol -2×3×391 kJ/mol ="-93" kJ/mol,即a=-93。(3) :C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol ①
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ/mol ②
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599 kJ/mol ③
由 (①×4+ ②-③)/2得2C(s,石墨)+H2(g)=C2H2(g) 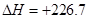 KJ/mol KJ/mol
考点:盖斯定律的应用和热化学方程式的书写
本题难度:困难
4、选择题 沼气是一种能源,它的主要成分是CH4。0.5mol CH4完全燃烧生成CO2和H2O(l),放出445 kJ热量,则下列热化学方程式中正确的是
[???? ]
A.2CH4(g) + 4O2(g) == 2CO2(g) + 4H2O(l) ΔH == +890 kJ·mol-1
B.CH4(g) + 2O2(g) == CO2(g) +2H2O(l) ΔH == +890 kJ·mol-1
C.CH4(g) + 2O2(g) == CO2(g) + 2H2O(l) ΔH == -890 kJ·mol-1
D. CH4(g) + O2(g) == CH4(g) + O2(g) == 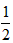 CO2(g) +H2O(l) ΔH == -890 kJ·mol-1 CO2(g) +H2O(l) ΔH == -890 kJ·mol-1
参考答案:C
本题解析:
本题难度:一般
5、填空题 (14分)煤是一种重要的化工原料,人们将利用煤制取的水煤气、焦炭、甲醚等广泛用于工农业生产中。
(1)已知:

①C(s) + H2O(g) === CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
②CO2(g) + H2(g) ===" CO(g)" + H2O(g) ΔH=+41.3 kJ·mol-1
则碳与水蒸气反应生成二氧化碳和氢气的热化学方程式为 。
该反应在 (填“高温”、“低温”或“任何温度”)下有利于正向自发进行。
(2)有人利用炭还原法处理氮氧化物,发生反应C(s)+2NO(g)  N2(g)+CO2(g)。向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如下表所示: N2(g)+CO2(g)。向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如下表所示:
时间(min)
浓度(mol·L-1)
| 0
| 10
| 20
| 30
| 40
| 50
| NO
| 1.00
| 0.68
| 0.50
| 0.50
| 0.60
| 0.60
| N2
| 0
| 0.16
| 0.25
| 0.25
| 0.30
| 0.30
| CO2
| 0
| 0.16
| 0.25
| 0.25
| 0.30
| 0.30
①10~20min内,N2的平均反应速率v(N2)= 。
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母序号)。
A.通入一定量的NO B.加入一定量的活性炭
C.加入合适的催化剂 D.适当缩小容器的体积
(3)研究表明:反应CO(g)+H2O(g)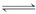 H2(g)+CO2(g)平衡常数随温度的变化如下表所示: H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
温度/℃
| 400
| 500
| 800
| 平衡常数K
| 9.94
| 9
| 1
若反应在500℃时进行,设起始时CO和H2O的浓度均为0.020 mol·L-1,在该条件下达到平衡时,CO的转化率为 。
(4)用CO做燃料电池电解CuSO4溶液、FeCl3和FeCl2混合液的示意图如图1所示,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。

①乙中A极产生的气体在标准状况下的体积为________________。
②丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2所示,则图中③线表示的是________(填离子符号)的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要________ mL 5.0 mol·L-1 NaOH溶液。
参考答案:(1)C(s) + 2H2O(g) = CO2(g) + 2
本题解析:
本题难度:困难
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772