|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 短周期元素A、X、D、E、R、T原子序数依次增大,原子结构及性质如表所示:
元素
| 结构及性质
| A
| A的原子半径最小
| X
| X原子最外层电子数是次外层的两倍
| D
| D是短周期中金属性最强的元素
| E
| E的最高价氧化物对应水化物是一种常见的两性氢氧化物
| R
| R与X同主族
| T
| T的负一价阴离子的核外电子排布与Ar原子相同
(1)R元素在周期表的位置是 ,化合物DT中存在的化学键是 。
(2)写出E单质与NaOH溶液反应的离子方程式 。
(3)1g X2A4 完全燃烧,恢复到常温时放出a kJ的热量,写出X2A4完全燃烧的热化学方程式 。
(4)RT4极易水解生成两种酸,写出该反应的化学方程式 。
(5)已知某温度下T的某一元含氧酸的Ka = 4.0×10-8,若一定浓度该酸的pH=4,则此溶液的物质的量浓度为 。
2、填空题 我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
I.已知反应 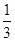 Fe2O3(s)+ CO(g) Fe2O3(s)+ CO(g) 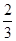 Fe(s)+ CO2(g) ΔH=-23.5 kJ·mol-1,该反应在 Fe(s)+ CO2(g) ΔH=-23.5 kJ·mol-1,该反应在
1000℃的平衡常数等于4。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1. 0mol,反应经过l0min后达到平衡。
(1)CO的平衡转化率=____________
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+ 2H2(g) CH3OH(g)。请根据图示回答下列问题: CH3OH(g)。请根据图示回答下列问题:
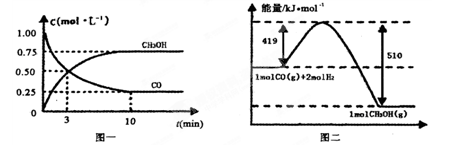
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=________
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡
3、选择题 盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H= - 24.8kJ/mol
3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H= - 47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
4、简答题 磷在氧气中燃烧,可能生成两种固态氧化物.3.1g的单质磷(P)在3.2g的氧气中燃烧,至反应物耗尽,并放出XkJ热量.
(1)通过计算确定反应产物的组成(用化学式表示)是______,其相应质量(g)为______.
(2)已知单质磷的燃烧热为YkJ/mol,则1mol?P与O2反应生成固态P2O3的反应热△H=______.
(3)写出1molP与O2反应生成固态P2O3的热化学方程式:______.
5、填空题 (16分)I.一定条件下铁可以和CO2发生反应:
Fe(s)+CO2(g) FeO(s)+CO(g) △H>0。1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。 FeO(s)+CO(g) △H>0。1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
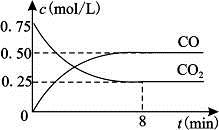
(1)8分钟内,CO的平均反应速率v(CO)=___________(结果保留3位有效数字)。
(2)1100℃时该反应的平衡常数K= (填数值);该温度下,若在8分钟时CO2和CO各增加0.5mol/L,此时平衡 移动(填“正向”、“逆向”或“不”)。
(3)1100℃时,2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器
| 甲
| 乙
| 反应物投入量
| 3molFe、2molCO2
| 4molFeO、3molCO
| CO的浓度(mol/L)
| C1
| C2
| CO2的体积分数
| φ1
| φ2
| 体系压强(Pa)
| P1
| P2
下列说法正确的是___________(填序号);
A.2C1 = 3C2 B.φ1 = φ2 C.P1<P2
II.(4)已知:①Fe(OH)3(aq) Fe3+(aq)+3OH-(aq);ΔH=" a" kJ?mol-1 Fe3+(aq)+3OH-(aq);ΔH=" a" kJ?mol-1
②H2O(l) H+(aq)+OH-(aq);ΔH="b" kJ?mol-1 H+(aq)+OH-(aq);ΔH="b" kJ?mol-1
请写出Fe3+发生水解反应的热化学方程式: 。
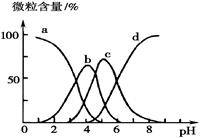
(5)柠檬酸(用H3R表示)可用作酸洗剂,除去水垢中的氧化铁。
溶液中H3R、H2R-、HR2--、R3-的微粒数百分含量与pH的关系如图所示。图中a曲线所代表的微粒数的百分含量随溶液pH的改变而变化的原因是 (结合必要的方程式解释)。调节柠檬酸溶液的pH=4时,溶液中上述4种微粒含量最多的是 (填微粒符号)。
III.(6)高铁酸钠(Na2FeO4)广泛应用于净水、电池工业等领域,工业常用电解法制备,其原理为
Fe+2OH--+2H2O FeO42--+3H2↑ FeO42--+3H2↑
请设计一个电解池并在答题卡的方框内画出该装置的示意图并作相应标注。

其阳极反应式为:________________________________。
|
|
|