?
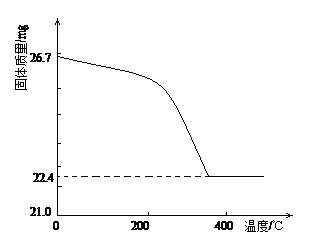
②定量研究:取26.7mg的干燥样品,加热,测的固体质量随温度的变化关系如下图。某同学由图中信息得出结论:假设一不成立。你是否同意该同学的结论,并简述理由:??????
?????????????????????????????????????????????????????????????。
参考答案:⑴K= c(SO42-)/c(CO32-)??
⑵ N
本题解析:⑴平衡常数表达式中的各物质的浓度为平衡浓度,且固体及纯液体的浓度为定值,不列在平衡常数表达式中,因此根据反应方程式容易写出反应的平衡常数表达式:K= c(SO42-)/c(CO32-)?。⑵HCO-3难电离,相同浓度时,Na2CO3溶液中CO2-3浓度远大于NaHCO3溶液中CO2-3的浓度,根据平衡移动原理CO2-3浓度大,平衡向正向移动,有利于PbSO4的转化。⑶根据信息及假设一,不难推出假设二和假设三分别为全部为PbCO3·Pb(OH)2、PbCO3与PbCO3·Pb(OH)2的混合物。⑷①若固体中
本题难度:一般
2、选择题 已知:Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
A.AgCl>AgI>Ag2CrO4
B.AgCl>Ag2CrO4>AgI
C.Ag2CrO4>AgCl>AgI
D.Ag2CrO4>AgI>AgCl
参考答案:C
本题解析:
试题分析:饱和溶液中:对应化学式相似的AgCl和AgI来说Ksp越小Ag+浓度越小,即AgCl>AgI;Ag2CrO4溶液中Ag+的浓度为 ,AgCl饱和溶液中Ag+的浓度为(1.8×10-10)0.5,所以有Ag2CrO4>AgCl>AgI,正确;选C。 ,AgCl饱和溶液中Ag+的浓度为(1.8×10-10)0.5,所以有Ag2CrO4>AgCl>AgI,正确;选C。
考点:考查难溶电解质的溶解平衡及沉淀转化的实质。
本题难度:一般
3、选择题 下列各项中的两个量,其比例为2:1的是(???)
A.pH=7的氨水与(NH4)2SO4的混合溶液中,c(NH4+)与c(SO42-)之比
B.同温度下,0.2mol/LCH3COOH溶液与0.1mol/L CH3COOH溶液中的c(H+)之比
C.液面在“0”刻度,50mL酸式滴定管和25mL酸式滴定管内所盛溶液的体积
D.0.2mol/L的NaHSO3溶液中的阳离子与阴离子的浓度之比
参考答案:A
本题解析:略
本题难度:简单
4、选择题 下列说法正确的是
A.汽油燃烧时将全部的化学能转化为热能
B.饱和石灰水中加入一定量生石灰,所得溶液的pH增大
C.向AgCl悬浊液中加入KI溶液,白色沉淀转化为黄色沉淀,说明溶解度AgCl<AgI
D.向AgCl悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动
参考答案:D
本题解析:略
本题难度:一般
5、填空题 (16分)
(1)等物质的量的A和B,混合于2L的密闭容器中,发生反应3A(g)+B(g)=xC(g)+2D(g),经过5min时,测得D的浓度为1mol/L,c(A):c(B)=3:4,C的反应速率是0.2mol?L-1?min-1,A在5min末的浓度是______,x的值是______.
(2)1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图(各物质为气体)
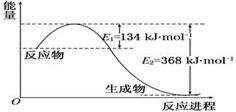
写出NO2和CO反应的热化学方程式____________________
(3)已知可逆反应:M(g)+N(g)  P(g)+Q(g);△H>0,请回答下列问题: P(g)+Q(g);△H>0,请回答下列问题:
①在某温度下,反应物的起始浓度分别为:c(M)=" 1" mol·L-1, c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为____
②平衡后,升高温度,平衡常数 。(增大、减小)
(4)t ℃时,水的离子积常数为1×10-13,则该温度 25℃(填大于,小于)。若将此温度下PH=11的苛性钠溶液a L与PH=1的稀硫酸b L混合(忽略混合后体积变化),若所得混合液为中性,则a :b= 。
(5)已知298K时, Ksp(CaCO3)=2.80×10-9, Ksp(CaSO4)=5.6×10-5 ,求此温度下该反应 的平衡常数K的数值为____ 的平衡常数K的数值为____
参考答案:(1)3 mol/L,x=2(2)NO2(g)+CO(g)=
本题解析:
试题分析:(1)假设AB的物质的量为n,D的浓度为1mol/L,所以D的物质的量为2摩尔,则列式计算:
3A(g)+B(g)=xC(g)+2D(g)
起始物质的量 n n 0 0
改变物质的量 3 1 x 2
5分末的物质的量 n-3 n-1 x 2
(n-3)/(n-1)=3/4 解n=9摩尔, x÷2÷5=0.2 x=2,所以A在5分末的浓度为(9-3)/2="3" mol/L,x=2。(2)根据图像分析1摩尔二氧化氮和1摩尔一氧化碳反应放热为364-134=234kJ的热量,热化学方程式写为:NO2(g)+CO(g)=CO2(g)+NO(g) △H=-234 kJ·mol-1。(3)①M的转化率为60%,则反应的M的物质的量浓度为1×60%=0.6 mol·L-1,根据反应方程式分析,N反应的物质的量浓度也为0.6 mol·L-1,则N的转化率=0.6/2.4=25%。②由于正反应为吸热,所以升温平衡正向移动,平衡常数增大。(4)因为常温下水的离子积常数为10-14,电离吸热,常数增大,说明平衡正向移动,温度升高,即温度大于25℃。在此温度下,pH=11的氢氧化钠溶液中氢氧根离子浓度=0.01 mol?L-1,pH=1的硫酸溶液中氢离子浓度为0.1 mol?L-1,弱酸碱混合后为中性,则氢离子和氢氧根离子物质的量相等,即体积比为10:1。(5)该反应的平衡常数=c(SO42-)/c(CO32-)= Ksp(CaSO4)/ Ksp(CaCO3)= 5.6×10-5/2.80×10-9=2×104。
考点:化学平衡计算,热化学方程式书写,化学平衡常数,酸碱混合。
本题难度:困难
|